Nitrogênio (N): o que é, para que serve e características
O nitrogênio é um elemento químico encontrado na tabela periódica e seu símbolo é representado pela letra N. Sua massa atômica é 14 u e seu número atômico é 7.
Quando dois átomos de nitrogênio se ligam formam a molécula N2. Essa substância é encontrada no estado gasoso na atmosfera em 78% e é insípida, inodora e incolor.
É um elemento essencial para a vida, pois constitui muitas moléculas orgânicas como, por exemplo, as proteínas, o DNA e o RNA.
Além disso, possui diversas aplicações industriais, na fabricação de fertilizantes, produção de amônia, na industria química e na preservação de alimentos.
Características do Nitrogênio
É um gás do Grupo 15 (Família 5a) da Tabela Periódica, simbolizado pela letra N, possui número atômico 7 e é classificado como ametal.
O nitrogênio gasoso encontrado na atmosfera (N2) não possui cor, cheio ou gosto, condensa-se a -196 °C e solidifica-se a -210 °C.
Está presente nos meteoritos, gases de vulcões, minas, no Sol e demais estrelas. Na Terra, pode ser encontrado na atmosfera, na chuva, no solo, no guano e nas proteínas, que constituem os organismos vivos.
Uma das formas de obtenção de nitrogênio líquido é através da destilação fracionada do ar atmosférico. Veja um resumo das etapas:
- Compressão do ar;
- Resfriamento;
- Separação por destilação fracionada;
- Liquefação do Nitrogênio;
- Armazenamento e transporte.
Ciclo do Nitrogênio
O ciclo do nitrogênio representa um fluxo de energias e matérias constantes na natureza. É dividido em quatro etapas: fixação, amonificação, nitrificação e denitrificação.
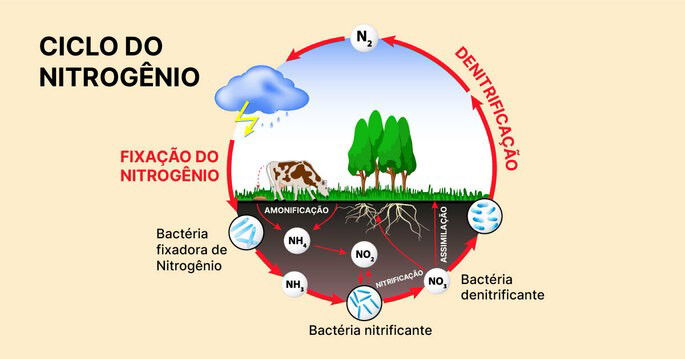
As plantas obtém o nitrogênio para a composição de suas biomoléculas através de compostos nitrogenados, como a amônia e os nitratos.
O nitrogênio chega ao solo por meio da chuva e pelos restos de vegetais e animais, cujas substâncias excretadas são ureia e ácido úrico.
Existem espécies de bactérias que são capazes de fixar o nitrogênio do ar. Algumas delas se associam às raízes de plantas da família Leguminosa (como feijões, soja e lentilha). Outras, no entanto, vivem livres no solo e realizam a mesma atividade.
A fixação do nitrogênio ao solo também pode ser feita durante as chuvas, quando descargas elétricas precipitam o ácido nítrico, absorvido pelo solo como nitratos.
Aplicações do nitrogênio
O nitrogênio pode ser utilizado em diversas aplicações, como listado a seguir:
- No congelamento e transporte de alimentos, e outros compostos orgânicos;
- No processo de fabricação de componentes eletrônicos (transistores, diodos, circuitos integrados, etc.);
- Na produção de aço inoxidável;
- Na fabricação de compostos orgânicos de nitrogênio, como a Nitroglicerina e o Trinitrotolueno (TNT).
Como o nitrogênio foi descoberto
Conhecido desde a Idade Média no Ocidente, o Nitrogênio era manipulado por alquimistas ao dissolver ouro com “aquafortis”, o ácido nítrico.
Foi apresentado formalmente por Daniel Rutherford em 1772, quando este precisou algumas de suas características. Contudo, foi Scheele quem isolou o elemento, no mesmo ano que Rutherford. Em 1877, Pictet e Cailletet liquefizeram o nitrogênio.
Curiosidades
- O processo Haber é utilizado na obtenção do gás amoníaco, o qual é matéria-prima para a fabricação de fertilizantes e ácido nítrico.
- O nitrogênio é o elemento mais caro dos fertilizantes, uma vez que sua produção é extremamente cara e dispendiosa.
- Os fertilizantes azotados são grandes poluidores do solo e das águas.
- O Nitrogênio é encontrado em todos os organismos vivos.
Leia mais:
- O que é Atmosfera?;
- Ciclo do Nitrogênio;
- Tabela Periódica;
- Rutherford;
- Composição do ar;
- Ciclos biogeoquímicos;
- Elementos químicos.
CASTILHO, Rubens. Nitrogênio (N): o que é, para que serve e características. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/nitrogenio/. Acesso em:

