Sais: o que são, exemplos, características e nomenclatura
Sais são substâncias químicas formadas por ligações iônicas entre os átomos. A função inorgânica sal corresponde aos compostos iônicos que possuem, pelo menos, um cátion diferente de H+ e um ânion diferente de OH-.
Os sais estão presentes em nosso cotidiano, sendo bastante utilizados na alimentação e também em outras áreas. São exemplos de sais:
- Cloreto de sódio (NaCl): conhecido popularmente como sal de cozinha
- Carbonato de cálcio (CaCO3): presente nos mármores e no calcário
- Sulfato de cálcio (CaSO4): compõe o giz escolar e o gesso
- Bicarbonato de sódio (NaHCO3): utilizado na culinária, medicamentos e como agente de limpeza
Essas substâncias são geralmente formadas em uma reação de neutralização, quando um ácido e uma base reagem e produzem um sal e água.
HCl(ácido) + NaOH(base) → NaCl(sal) + H2O(água)
Nesta reação, os reagentes ácido clorídrico (HCl) e hidróxido de sódio (NaOH) formam os produtos cloreto de sódio (NaCl) e água (H2O).
Na ligação iônica ocorre com a transferência de elétrons entre os átomos e para isso um dos átomos deve ser um metal e o outro um ametal. Com isso, formam-se espécies químicas positivas, os cátions, por doarem elétrons e os de carga negativa, ânions, que os receberam.
Observe na imagem a seguir como ocorre a formação do cloreto de sódio (NaCl).
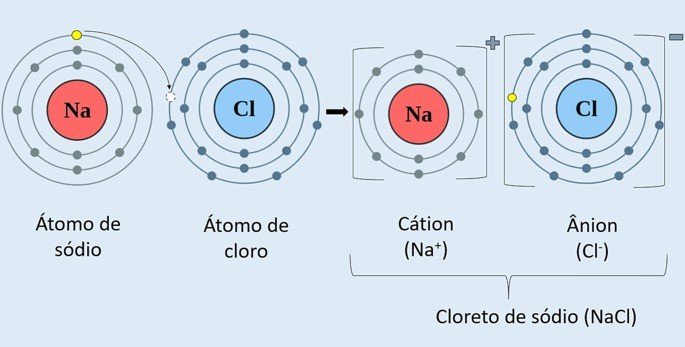
O átomo do metal sódio (Na) doa um elétron para o átomo de cloro (Cl). Sendo assim, forma-se o cátion Na+, que consiste no íon de sódio positivo, e o ânion Cl-, que corresponde ao íon de cloro negativo.
Saiba mais sobre ácidos e bases.
Características dos sais
Importante observar que, em solução aquosa, os ácidos liberam sempre cátion H+ e as bases liberam o ânion OH- (conceito de Arrhenius).
Os sais, porém, não possuem sempre o mesmo cátion ou ânion e, por esse motivo, não revelam propriedades funcionais bem definidas. Entretanto, podemos dizer que no geral:
- São compostos iônicos (formados por aglomerados de íons e não por moléculas);
- Muitos apresentam sabor salgado característico (quase sempre venenosos);
- São sólidos e cristalinos;
- Conduzem corrente elétrica em solução;
- Sofrem fusão e ebulição em altas temperaturas;
- Solúveis em água (exceções: alguns sulfetos; os cloretos, brometos e iodetos com os cátions Ag+, Hg22+ e Pb2+, entre outros).
Classificação e nomenclatura dos sais
Segundo o modo como ocorre a reação de formação dos sais, são classificados em três tipos:
Sais neutros ou normais
Reação de neutralização total (reagem todos os H+ do ácido e todas as OH- da base). Esses sais quando dissolvidos em água não alteram o pH.
Exemplos:
NaOH (base) + HCl (ácido) → NaCl (sal normal) + H2O
3NaOH (base) + H3PO4 (ácido) → Na3PO4 (sal normal) + 3H2O
Nome dos Sais Normais: o nome do sal provém do nome do ânion do ácido, cuja terminação _ídrico ou _oso ou _ico será substituída respectivamente por: _eto ou_ito ou _ato e do cátion da base.
Sal = (nome do ânion) + sufixo eto/ito/ato de (nome do cátion).
Assim:
- ácido clorídrico (HCl) + hidróxido de sódio (NaOH) → cloreto de sódio (NaCl) + água
- ácido nitroso(HNO2) + hidróxido de potássio(KOH) → nitrito de potássio(KNO2) + água
- ácido ortofosfórico (2H3PO4) + hidróxido de cálcio(3Ca(OH)2 → ortofosfato de cálcio [Ca3(PO4)2] + água (6H2O)
Sais ácidos ou hidrogenossais
Reação de neutralização parcial do ácido (quando nem todos os H+ do ácido reagem, então o sal possui em sua estrutura um ou mais hidrogênios ionizáveis oriundos do ácido).
Exemplo:
NaOH (base) + H2SO4 (ácido) → NaHSO4 (sal ácido) + H2O
Nome dos Sais Ácidos: semelhante aos sais normais, mas com indicação do número de H+ pelos prefixos mono, di, tri, etc.
Sal = prefixo do nº de H+ + (nome do ânion) + sufixo eto/ito/ato de (nome do cátion).
ácido sulfúrico (H2SO4) + hidróxido de sódio(NaOH) → monoidrogenosulfatode sódio (NaHSO4) + água
ácido ortofosfórico (H3PO4) + hidróxido de sódio(NaOH) → diidrogeno-ortofosfato de sódio (NaH2PO4) + água
Sais básicos ou hidroxissais
Reação de neutralização parcial da base (Se nem todas as hidroxilas reagirem, o sal tem em sua estrutura uma ou mais hidroxilas).
Exemplo:
Ca(OH)2 (base) + HCl (ácido) → Ca(OH)Cl (sal básico) + H2O
Nome dos Sais Básicos: semelhante aos sais normais, indicando porém o número de OH-em sua estrutura.
Sal = prefixo do nº de OH-+ (nome do ânion) + sufixo eto/ito/ato de (nome do cátion).
ácido clorídrico (HCl) + hidróxido de cálcio [Ca(OH)2] → monoidroxicloreto de cálcio [Ca(OH)Cl] + água
ácido clorídrico (2HCl) + hidróxido de alumínio [Al(OH)3] → monoidroxicloretode alumínio [Al(OH)Cl2] + água
Sais duplos ou mistos
Reação de um di, tri ou tetrácido com diferentes bases (sal duplo quanto ao cátion) ou de um uma di, tri ou tetrabase com ácidos diferentes (sal duplo quanto ao ânion).
Exemplos:
Quanto ao cátion:
H2SO4 (diácido) + KOH (base) + NaOH (base) → KNaSO4 (sulfato duplo de potássio e sódio) + 2H2O
H3PO4 (triácido) + 2KOH (base) + NaOH (base) → K2NaPO4 (ortofosfato dipotássio monossódico)
Quanto ao ânion:
Ca(OH)2 (dibase) + HBr (ácido) + HCl (ácido) → CaBrCl (cloreto-brometo de cálcio) + 2H2O
Al(OH)3 (tribase) + H2SO4(ácido) + HCl (ácido) → Al(SO4)Cl (cloreto-sulfato de alumínio) + 3H2O
Conheça as principais funções inorgânicas e não deixe de conferir questões de vestibulares sobre o tema, com resolução comentada, em: exercícios sobre funções inorgânicas.
Exercícios sobre sais
Questão 1
1. Qual das seguintes afirmações descreve corretamente a ligação iônica em sais?
a) Compartilhamento de elétrons entre átomos
b) Atração eletrostática entre íons de cargas opostas
c) Ligação entre átomos neutros
d) Formação de moléculas estáveis
Gabarito:
Correta: b) Atração eletrostática entre íons de cargas opostas
Essa é a essência da ligação iônica. Um átomo doa elétrons para outro, formando íons de cargas opostas (um positivo - cátion e um negativo - ânion). A força de atração eletrostática entre esses íons é o que mantém o sal unido.
Incorretas:
a) Compartilhamento de elétrons entre átomos.
Essa é a definição de ligação covalente, onde os átomos compartilham elétrons para atingir uma configuração eletrônica estável. Sais não se formam por compartilhamento de elétrons.
c) Ligação entre átomos neutros
Átomos neutros não possuem carga elétrica. A ligação iônica envolve íons, que são átomos que ganharam ou perderam elétrons e, portanto, possuem carga elétrica.
d) Formação de moléculas estáveis
Moléculas são formadas por ligações covalentes, onde há compartilhamento de elétrons. Sais são compostos iônicos, formados por atração eletrostática entre íons.
Questão 2
Continue aprofundando os seus estudos com:
- Exercícios sobre sais (com respostas explicadas)
- Ácidos: o que são, suas características e tipos (com exemplos)
- Óxidos: o que são, classificação e exemplos
- Bases
CAMPOS, Adriana. Sais: o que são, exemplos, características e nomenclatura. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/caracteristicas-e-principais-tipos-de-sais/. Acesso em:


