Equilíbrio Químico
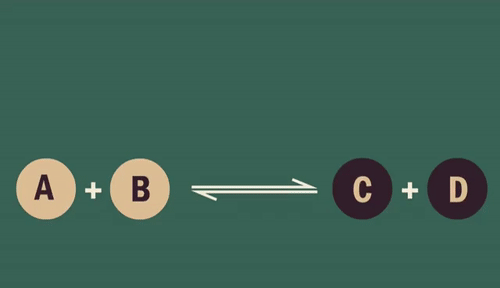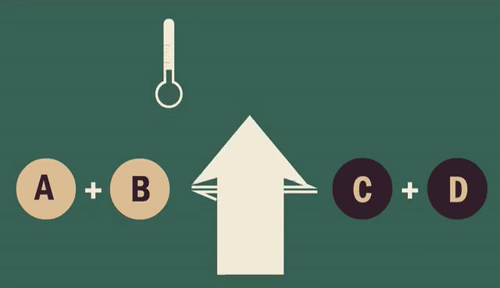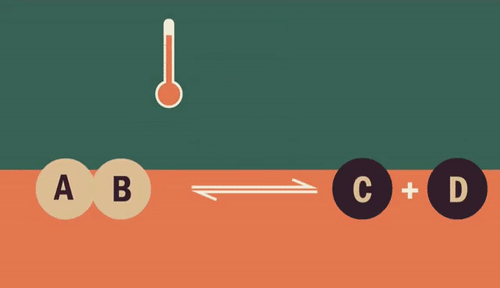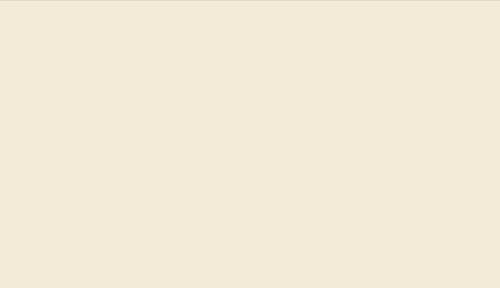
O equilíbrio químico é um fenômeno que acontece nas reações químicas reversíveis entre reagentes e produtos.
Quando uma reação é direta, está transformando reagentes em produtos. Já quando ela ocorre de maneira inversa, os produtos estão transformando-se em reagentes.
Para ocorrer um equilíbrio químico é necessário que:
- a temperatura seja constante
- o sistema não tenha trocas com o ambiente
Quando um ponto de equilíbrio é atingido nas reações reversíveis tem-se:
- a velocidade das reações direta e inversa iguais.
- a concentração constante das substâncias presentes na reação.
O equilíbrio químico é medido por duas grandezas: a constante de equilíbrio e o grau de equilíbrio.
Ele pode ser alterado quando ocorre mudanças de: concentração, temperatura, pressão e uso de catalisadores.
Reações Químicas Reversíveis
Exemplo de equação química:
No primeiro membro (antes da seta) aparecem os reagentes, ou seja, as substâncias que entram na reação.
No segundo membro (depois da seta) estão os produtos, isto é, as substâncias que foram formadas pela reação.
Em uma reação reversível ela pode ocorrer nos dois sentidos (representado por ):
Assim, nas reações diretas os reagentes formam produtos (reagentes → produtos). Já nas reações inversas, os produtos formam reagentes (produtos → reagentes).
Gráficos de Equilíbrio Químico
Podemos expressar o equilíbrio químico graficamente utilizando as variáveis velocidade e concentração (eixo y) em função do tempo (eixo x).
O equilíbrio é observado graficamente quando as linhas do gráfico se tornam horizontais, tanto para velocidade quanto para a concentração.
Velocidade x tempo
Observamos que v1 vai diminuindo à medida que os reagentes se transformam em produtos. Já v2 aumenta quando os produtos estão sendo formados.
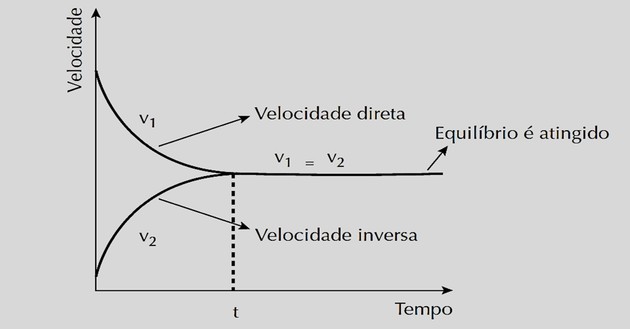
Ao atingir o equilíbrio químico, a velocidade das reações direta e inversa se tornam iguais.
Concentração x tempo
Observamos que a concentração dos reagentes é máxima e diminui porque eles estão sendo transformados em produtos. Já a concentração dos produtos parte do zero (porque no início da reação só haviam reagentes) e vai crescendo a medida que estão sendo criados.
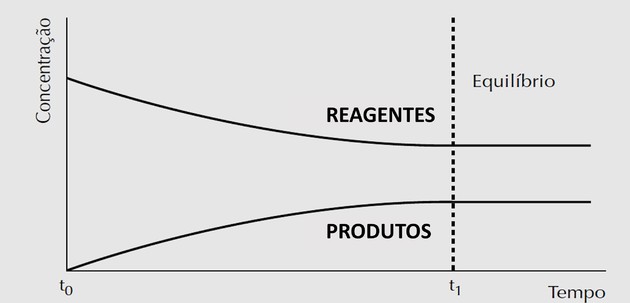
Quando o equilíbrio químico é atingido, a concentração das substâncias presentes na reação é constante, mas não necessariamente iguais.
Tipos de Equilíbrio Químico
Sistemas homogêneos
São aqueles que os componentes do sistema, reagentes e produtos, encontram-se na mesma fase.
Sistemas gasosos
Soluções
Sistemas heterogêneos
Os componentes da reação, reagentes e produtos, estão em mais de uma fase.
Constante de Equilíbrio (K)
A constante de equilíbrio (Kc) é uma grandeza que caracteriza o equilíbrio químico levando em consideração os aspectos cinéticos das reações químicas e as soluções em equilíbrio dinâmico.
No equilíbrio químico, as taxas de reação de um sentido de reação e seu inverso devem ser iguais.
Sendo assim, foi estabelecido que a constante de equilíbrio é obtida por:
O valor de K varia conforme a temperatura.
Constante de equilíbrio em função da concentração (Kc)
Dada a equação química:
Expressamos a constante de equilíbrio da seguinte forma:
Sendo que:
- [ ] é a concentração em mol/L
- a, b, c e d são os coeficientes estequiométricos
Exemplo:
| Equação química | Constante de equilíbrio Kc |
|---|---|
Atribuindo, por exemplo, valores para as concentrações temos:
| Concentrações | Cálculo da constante de equilíbrio Kc |
|---|---|
| [N2] = 0,20 mol/L | |
| [H2] = 0,20 mol/L | |
| [NH3] = 0,60 mol/L |
Outros exemplos:
| Equações químicas | Constante de equilíbrio (Kc) |
|---|---|
|
|
|
|
|
|
|
|
Observe que quando na reação tivermos algum componente no estado sólido ou um líquido puro, como a água, as concentrações dessas substâncias não participam do cálculo da constante e são substituídas pelo número 1.
Constante de equilíbrio em função das pressões parciais (Kp)
É utilizada quando pelo menos um dos participantes da reação está no estado gasoso e as quantidades são expressas em termos de pressões parciais.
Exemplo: equilíbrio homogêneo (todos os componentes são gases)
| Equação química | Constante de equilíbrio Kp |
|---|---|
Outros exemplos: equilíbrio heterogêneo (componentes em mais de uma fase)
| Equações químicas | Constante de equilíbrio Kp |
|---|---|
|
|
|
|
|
Observe que para o cálculo de Kp apenas os gases participam.
Relação entre Kc e Kp
Sendo que:
- Kp é a constante de equilíbrio em função das pressões parciais
- Kc é a constante de equilíbrio em função das concentrações
- R é a constante dos gases e utilizamos
quando a pressão parcial é expressa em atm
- T é a temperatura em Kelvin (
)
- Δn é a variação do número de mols (mols dos produtos - mols dos reagentes) e apenas leva em consideração os coeficientes das substâncias no estado gasoso.
Exemplo:
| Equação química | Constante de equilíbrio Kp |
|---|---|
|
sendo, por exemplo, T = 300 K e Kc = 225 |
Grau de Equilíbrio
O grau de equilíbrio (α) corresponde ao rendimento de uma reação química por meio da relação entre o reagente e a quantidade de mols desse reagente.
Dessa forma, o grau de equilíbrio indica a porcentagem em mols de uma substância até atingir o equilíbrio químico.
Note que quanto maior for o grau de equilíbrio, maior a chance da reação atingir o equilíbrio.
Exemplo:
Dada a equação química:
Supondo que a reação inicia com 100 mols de A. Se, ao chegarmos ao equilíbrio, ainda houver 20 mols de A sem reagir, qual o grau de equilíbrio ele relação ao reagente A?
Resolução: Como no equilíbrio ainda há 20 mols de A, significa que a quantidade que reagiu foi de 80 mols. Aplicando na fórmula de grau de equilíbrio, temos:
Para o grau de equilíbrio, temos que:
Quanto maior o valor de α, maior é o caminho percorrido pela reação até chegar o equilíbrio.
Leis do Equilíbrio Químico
Lei de ação das massas
A previsão de como o equilíbrio químico é estabelecido foi determinada em 1864 pelos cientistas noruegueses Cato Maximilian Guldberg e Peter Waage. Após observar os aspectos cinéticos das reações reversíveis, eles concluíram que:
“A velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, quando estes estão elevados a expoentes, que são os seus respectivos coeficientes estequiométricos.”
A constante de equilíbrio (Kc) foi criada em termos de concentrações molares dos participantes da reação e essa expressão recebe o nome de lei da ação das massas ou lei Guldberg-Waage.
Princípio de Le Chatelier
O químico francês Henry Louis Le Chatelier, em 1884, observando as alterações das propriedades físicas e químicas de um equilíbrio químico fez a seguinte generalização:
“Quando um fator externo age sobre um sistema em equilíbrio, este se desloca, sempre no sentido de minimizar a ação do fator aplicado.”
Segundo Le Chatelier, quando mudamos alguma propriedade de um sistema em equilíbrio, a alteração faz com que o sistema busque uma forma de minimizar essa modificação e um novo equilíbrio é formado quando a velocidade das reações direta e inversa se igualam e as concentrações das substâncias das reações tornam-se novamente constantes.
Pelo seu empenho em desenvolver estudos nessa área, Le Chatelier sempre é lembrado quando se fala em equilíbrio químico.
Deslocamento do Equilíbrio Químico
O deslocamento de equilíbrio corresponde a uma alteração da velocidade de uma reação direta ou inversa. Como enuncia o princípio de Le Chatelier, sempre que uma alteração ocorrer no equilíbrio ele se desloca a fim de minimizar essa pertubação.
O resultado desses deslocamentos gera um novo estado de equilíbrio no sistema químico. Além da concentração, a pressão e a temperatura influenciam nesse processo. Já o uso de catalisadores faz com que o equilíbrio seja atingido de maneira mais rápida.
Influência da concentração
Quando aumentamos a quantidade de uma substância (reagente ou produto) em uma reação, o equilíbrio se desloca para ser restabelecido, transformando essa substância.
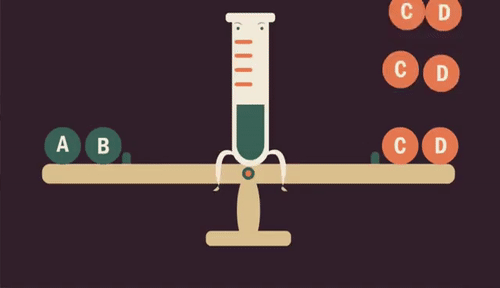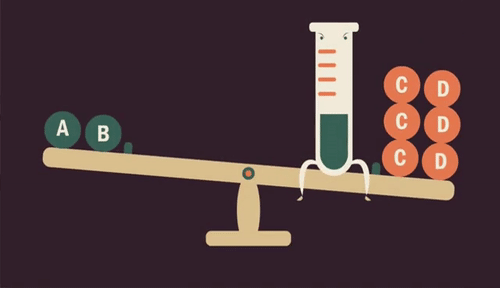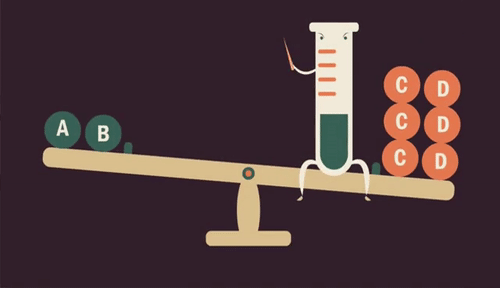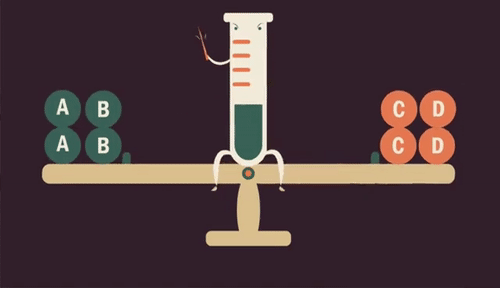
Da mesma forma, se retirarmos uma substância da reação, diminuindo sua quantidade, o equilíbrio é restabelecido produzindo mais dessa substância.
Influência da temperatura
Quando se diminui a temperatura de um sistema, desloca-se o equilíbrio liberando mais energia, ou seja, a reação exotérmica é favorecida.
Da mesma forma, ao aumentar a temperatura, o equilíbrio é restabelecido absorvendo energia, favorecendo a reação endotérmica.
Influência da pressão
O aumento da pressão total faz com que o equilíbrio se desloque para o sentido do menor volume.
Mas, se diminuirmos a pressão total, o equilíbrio tende a se deslocar para o sentido do maior volume.
Exemplo:
Dada a equação química:
- Concentração: aumentando a quantidade de N2 na reação, o equilíbrio se desloca para direita, formando mais produto.
- Temperatura: aumentando a temperatura, o equilíbrio se desloca para esquerda, favorecendo a reação endotérmica (absorvendo energia) e formando mais reagentes.
- Pressão: aumentando a pressão, o equilíbrio se desloca para direita, que tem menor volume (número de mols).
Influência do catalisador
Quando adicionamos um catalisador ao sistema, essa substância aumentará a velocidade das reações direta e inversa, diminuindo então o tempo necessário para que o equilíbrio químico seja atingido, mas não altera a concentração das substâncias.
Cálculos de Equilíbrio Químico
Aproveite as questões abaixo para ver como os cálculos que envolvem equilíbrio químico são abordados nos vestibulares e o passo a passo para resolver as questões.
Cálculo da constante de equilíbrio Kc
1. (PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está representado pela equação:
2 SO2(g) + O2 (g) → 2 SO3 (g)
Em um recipiente de 1 litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de oxigênio. Depois de algum tempo, o sistema atingiu o equilíbrio; o número de mols de trióxido de enxofre medido foi 4. O valor aproximado da constante de equilíbrio é:
a) 0,53.
b) 0,66.
c) 0,75.
d) 1,33.
e) 2,33.
Cálculo da constante de equilíbrio Kp
2. (UFES) Numa dada temperatura, as pressões parciais de cada componente da reação: N2(g) + O2(g) ⇄ 2 NO no equilíbrio valem, respectivamente, 0,8 atm, 2 atm e 1 atm. Qual será o valor do Kp?
a) 1,6.
b) 2,65.
c) 0,8.
d) 0,00625.
e) 0,625.
Cálculo da relação entre Kc e Kp
3. (PUC-SP) No equilíbrio N2(g) + 3 H2(g) ⇄ 2 NH3(g) verifica-se que Kc = 2,4 x 10-3 (mol/L)-2 a 727 oC. Qual o valor de Kp, nas mesmas condições físicas? (R = 8,2 x 10-2 atm.L.K-1.mol-1).
Saiba mais:
BATISTA, Carolina. Equilíbrio Químico. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/equilibrio-quimico/. Acesso em:


