Exercício sobre polaridade das moléculas (com gabarito resolvido)
A polaridade de uma molécula depende da eletronegatividade dos átomos constituintes e da sua geometria.
Se todas as ligações são apolares, qualquer que seja a geometria, a molécula é apolar. Se existem ligações polares, a molécula pode ser polar ou apolar.
Como identificar:
- Localize o centro de cargas positivas
- Localize o centro de cargas negativas
- Se os dois centros se anulam, a molécula é apolar. Se os dois centros não se anulam, a molécula é polar.
Desenvolva seus conhecimentos sobre esse tema com as questões a seguir.
Questão 1
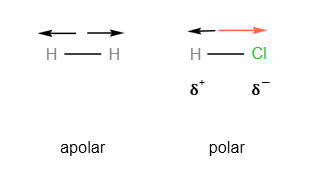
Considerando as moléculas de H2 e HCl e suas polaridades, assinale a alternativa correta:
a) Ambas as moléculas são polares, pois possuem ligações covalentes polares.
b) O H2 é polar, enquanto o HCl é apolar devido à sua ligação simples.
c) O H2 é apolar, enquanto o HCl é polar devido à diferença de eletronegatividade entre seus átomos.
d) O H2 e o HCl são apolares, pois possuem ligações covalentes.
e) Ambas as moléculas são apolares, pois seus átomos possuem eletronegatividades idênticas.
Gabarito: c) O H2 é apolar, enquanto o HCl é polar devido à diferença de eletronegatividade entre seus átomos.
Na molécula de H2, os dois átomos, sendo idênticos, possuem a mesma eletronegatividade. Isso resulta em uma distribuição simétrica das cargas, tornando a molécula apolar.
Já na molécula de HCl, os átomos possuem eletronegatividades diferentes. O cloro, por ser mais eletronegativo, atrai o par eletrônico para mais perto de si, criando uma separação de cargas e tornando a molécula polar.
Questão 2
A polaridade de uma molécula depende da eletronegatividade dos átomos e de sua geometria molecular. Com base nisso, analise as moléculas de CO2 e H2O e assinale a alternativa correta:
a) Ambas as moléculas são polares, pois possuem átomos com eletronegatividades diferentes.
b) O CO2 é polar, enquanto a H2O é apolar devido à presença de ligações covalentes.
c) O CO2 é apolar, enquanto a H2O é polar devido ao seu formato angular.
d) O CO2 e a H2O são apolares, pois suas ligações são covalentes.
e) Ambas as moléculas são apolares, pois possuem uma distribuição simétrica de cargas.
Gabarito: c) O CO2 é apolar, enquanto a H2O é polar devido ao seu formato angular.
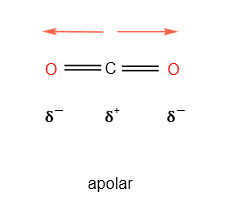
A molécula de CO2 tem duas ligações polares, pois o oxigênio é mais eletronegativo do que o carbono.
Como a molécula é linear, a atração do oxigênio “da esquerda” é contrabalanceada pela atração do oxigênio “da direita” e como resultado temos a molécula apolar.
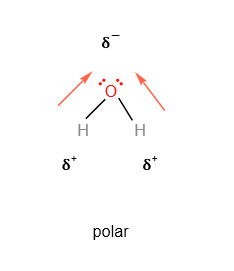
A molécula da água tem duas ligações polares, pois o oxigênio é mais eletronegativo do que o hidrogênio.
Na geometria angular da água, o lado dos hidrogênios é eletropositivo e o oxigênio eletronegativo. Como resultado temos a molécula polar.
Questão 3
A eletronegatividade é a capacidade de um átomo atrair elétrons em uma ligação química. Calcule a diferença de eletronegatividade das moléculas F2, HF e LiF e assinale a alternativa correta.
Dados dos valores de eletronegatividade:
F: 4,0
H: 2,1
Li: 1,0
a) A diferença de eletronegatividade do F2 é 4,0 e é uma molécula apolar.
b) A diferença de eletronegatividade do HF é 1,9 e é uma molécula polar.
c) A diferença de eletronegatividade do LiF é 2,0 e é uma molécula apolar.
d) A diferença de eletronegatividade do HF é 1,0 e é uma molécula apolar.
e) A diferença de eletronegatividade do F2 é 2,0 e é uma molécula polar.
Gabarito: b) A diferença de eletronegatividade do HF é 1,9 e é uma molécula polar.
A molécula do F2
F–F
4,0 - 4,0 = 0 → apolar
A molécula HF
H–F
4,0 - 2,1 = 1,9 → polar
A molécula do LiF
Li–F
4,0 - 1,0 = 3,0 → polar
Questão 4
O cloro, pertencente ao grupo dos halogênios, é um dos elementos mais eletronegativos da Tabela Periódica. A polaridade de uma ligação covalente pode ser determinada pela diferença de eletronegatividade entre os átomos envolvidos.
Considere a seguinte tabela com valores de eletronegatividade:
| Elemento | Eletronegatividade |
| Boro (B) | 2,0 |
| Carbono (C) | 2,5 |
| Fósforo (P) | 2,1 |
| Cloro (Cl) | 3,0 |
Com base nesses dados, calcule a diferença de eletronegatividade nas ligações B–Cl, C–Cl e P–Cl e identifique qual delas é a mais polar.
a) A diferença de eletronegatividade do B–Cl é 1,0 e é a ligação mais polar.
b) A diferença de eletronegatividade do P–Cl é 0,9 e é a ligação mais polar.
c) A diferença de eletronegatividade do B–Cl é 1,0 e é mais polar que a ligação P–Cl.
d) A diferença de eletronegatividade do B–Cl é 1,0 e é mais polar que a ligação C–Cl.
Gabarito: d) A diferença de eletronegatividade do B–Cl é 1,0 e é mais polar que a ligação C–Cl.
Calculando a diferenças de eletronegatividades, temos:
B–Cl
2,0 - 3,0 = 1,0
C–Cl
2,5 - 3,0 = 0,5
P–Cl
2,1 - 3,0 = 0,9
Em sequência crescente de eletronegatividade: C–Cl < P–Cl < B–Cl
Questão 5
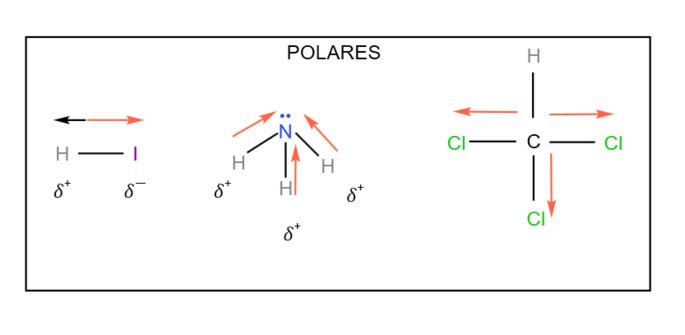
A polaridade das moléculas é determinada pela diferença de eletronegatividade entre os átomos e pela geometria molecular. Com base nesses critérios, classifique as seguintes moléculas em polares e apolares:
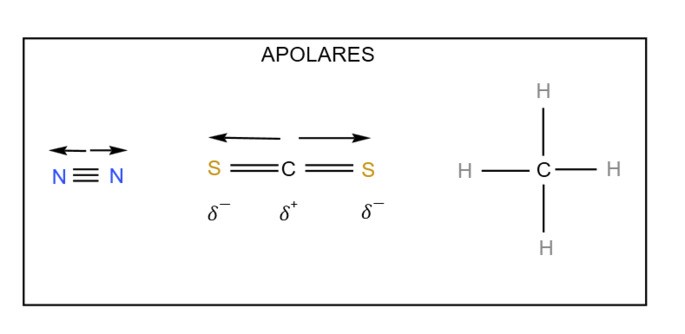
N2, HI, NH3, CS2, CH4, CHCl3
Assinale a alternativa que apresenta corretamente a divisão entre moléculas polares e apolares:
a) Polares: N2, HI, NH3 | Apolares: CS2, CH4, CHCl3
b) Polares: HI, NH3, CHCl3 | Apolares: N2, CS2, CH4
c) Polares: NH3, CH4, CS2 | Apolares: N2, HI, CHCl3
d) Polares: N2, CHCl3, CH4 | Apolares: HI, NH3, CS2
e) Polares: N2, HI, CHCl3 | Apolares: NH3, CS2, CH4
Gabarito: b) Polares: HI, NH3, CHCl3 | Apolares: N2, CS2, CH4
Observe as estruturas abaixo para melhor compreensão.
Questão 6
Leia também: Polaridade das moléculas e Moléculas polares e apolares
VIEIRA, Natália. Exercício sobre polaridade das moléculas (com gabarito resolvido). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicio-sobre-polaridade-das-moleculas-com-gabarito-resolvido/. Acesso em:


