Exercícios de química para 2º ano do ensino médio (com respostas explicadas)
Confira a seguir uma lista com 10 exercícios de Química para o 2º ano do Ensino Médio. Os exercícios abrangem as habilidades sugeridas pela Base Nacional Comum Curricular (BNCC).
Questão 01
É possível obter elevada pureza do metal manganês (Mn) em alguns processos utilizando alumínio. Observe a equação de purificação do manganês e realize o balanceamento:
a)
b)
c)
d)
e)
Resposta correta: letra a -
Para balancear uma equação química lembremos da regra MACHO, para nortear a ordem de balanceamento. Primeiro verifica-se os Metais, em seguida os Ametais, logo após o Carbono, o Hidrogênio e, por fim, o Oxigênio.
É possível verificar que o Mn está devidamente balanceado de ambos os lados, mas o Al não. Ao lado dos produtos encontramos dois átomos de Al, contudo há três átomos de Oxigênio no óxido de alumínio (Al2O3). Dessa maneira, é interessante incluir o coeficiente 3 à frente do óxido de manganês (MnO2) presente nos reagentes, assim teremos 3 x 2 = 6, e o coeficiente 2 à frente do óxido de alumínio (Al2O3) presente nos produtos (3 x 2 = 6).
Assim sendo, será preciso balancear o alumínio, que no lado dos produtos encontra-se em 4 unidades (2 x 2 = 4), logo será necessário incluir o coeficiente 4 no Al nos reagentes.
Por fim, observamos o Mn que está com coeficiente 3 nos reagentes e 1 nos produtos. Dessa maneira, será necessário incluir o coeficiente 3 à frente do Mn presente nos produtos.
Ao realizar essas etapas a equação estará balanceada com os menores números inteiros possíveis.
Questão 02
Observe a equação química abaixo e responda o que se pede:
Realize o balanceamento da equação e diga quantas moléculas de O2(g) são consumidas na combustão completa de 5 mols de álcool etílico (C2H6O).
a)
São consumidas 90 x 1024 moléculas de O2
b)
São consumidas 9,0 x 1023 moléculas de O2
c)
São consumidas 9,0 x 1024 moléculas de O2
d)
São consumidas 9,0 x 1024 moléculas de O2
e)
São consumidas 90 x 1023 moléculas de O2
Resposta correta: letra b.
- São consumidas 9,0 x 1024 moléculas de O2.
O primeiro passo na resolução dessa questão é realizar o balanceamento através da Lei da Conservação das Massas (Lavosier) e Lei das Proporções Constantes (Proust). Ao finalizar o balanceamento você saberá quantos mols de cada substância, reagentes e produtos, estão envolvidos na reação.
Em seguida, por meio de regra de três, é possível resolver a questão levando em consideração um conhecimento prévio, a constante de Avogadro.
A constante de Avogadro diz que 1 mol de uma determinada substância equivale a, aproximadamente, 6,0 . 1023 moléculas. Assim temos que:
1 mol de C2H6O ------- 3 . 6,0 . 1023 moléculas de O2
5 mols de C2H6O ------ x moléculas de O2
Realizando os cálculos, temos que:
moléculas de O2.
Logo, temos que o resultado será:
x = 90 . 1023 moléculas de O2.
Porém, como estamos trabalhando com notação científica, é preciso manter o valor final em notação. Dessa forma, o resultado final será:
x = 9,0 . 1024 moléculas de O2 sendo consumidas na combustão completa do álcool etílico.
Questão 03
Realize o balanceamento da equação abaixo, com os menores números inteiros possíveis, e responda.
Qual é o volume de O2 produzido após a reação em Condições Normais de Temperatura e Pressão (CNTP)?
a)
O volume de O2 após a reação é de 80 L.
b)
O volume de O2 após a reação é de 150 L
c)
O volume de O2 após a reação é de 134,4 L
d)
O volume de O2 após a reação é de 80 L
e)
O volume de O2 após a reação é de 134,4 L
Resposta correta: letra e:
- O volume de O2 após a reação é de 134, 4 L.
Para iniciar o processo, precisamos realizar o balanceamento da equação química para que ambos os lados estejam equivalentes, reagentes e produtos, levando em consideração as Leis da conservação das massas e proporções definidas.
Observe que a questão pede que seja realizada com os menores números inteiros possíveis para os coeficientes. Além disso, é necessário relembrar a equivalência do mol para volume em CNTP é:
1 mol = 22,4 L.
Assim, temos que:
1 mol de O2 -------- 22, 4 L de O2
6 mols de O2 ------ x L de O2
Realizando os cálculos, obtemos:
Logo, x = 134,4 L de O2 produzido.
Questão 04
Na molécula H2SO4, ácido sulfúrico, quantas ligações o enxofre realiza para haver estabilidade química entre as espécies químicas envolvidas?
a) Duas ligações, pois é o que precisa para completar o octeto
b) Quatro ligações, pois é o que precisa para completar o octeto
c) Seis ligações, pois é o que precisa para completar o octeto
d) Seis ligações, pois o enxofre, em conjunto com alguns outros elementos, não segue a regra do octeto
e) Quatro ligações, pois o enxofre não segue a regra do octeto
Resposta correta: letra d - Seis ligações, pois o enxofre, em conjunto com alguns outros elementos, não segue a regra do octeto.
Para haver estabilidade entre os elementos ligantes, o enxofre se torna hexavalente. Isso porque, o enxofre nem sempre segue a regra do octeto. Ele fará a quantidade de ligações necessária para que os elementos ligantes se estabilizem. Assim, temos a seguinte condição:
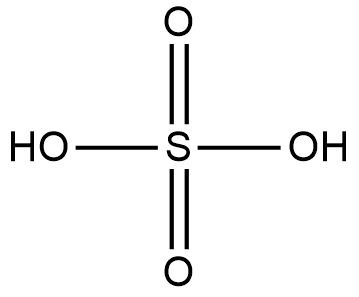
Se contar o número de ligações realizadas pelo enxofre (S), perceberá que são seis.
Questão 05
Qual é o Nox do enxofre presente na molécula H2SO3 e do fósforo presente na substância H3PO4, respectivamente?
a) +4 e +5
b) +2 e +2
c) +2 e + 3
d) +4 e +4
e) +2 e +6
Resposta correta: letra a: +4 e +5.
Para realizar esta questão é necessário saber calcular o Número de Oxidação (Nox) de um elemento. É muito comum, em ambientes escolares, a pratica da memorização das tabelas de Nox, contudo, se você souber montar a estrutura de Lewis para cada fórmula molecular não será necessário decorar.
Observe a estrutura do ácido sulfuroso (H2SO3):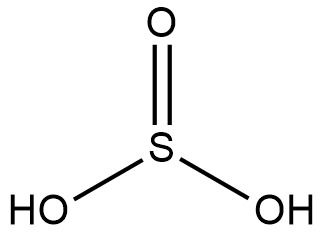
Para obter o Nox do enxofre, basta observar os elementos que se ligam a ele e ver quem é mais eletronegativo. Nesse caso, o enxofre está ligado a três oxigênios. O oxigênio é mais eletronegativo do que o enxofre, se olhar na tabela de eletronegatividade verá que o oxigênio possui 3,5 de eletronegatividade e o enxofre 2,6. Logo, há uma tendência maior dos oxigênios atrairem a nuvem eletrônica do enxofre para si. Portanto, basta contar quantas ligações o enxofre faz que será equivalente ao Nox.
Como ele faz quatro ligações, seu Nox será 4. E como ele é menos eletronegativo que os oxigênios terá uma carga positiva (+), logo +4.
O mesmo é feito para o ácido fosfórico (H3PO4). Observe:
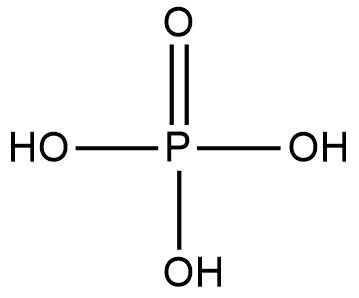
Existem quatro ligações ocorrendo com oxigênios. O fósforo possui 2,2 de eletronegatividade contra 3,5 do oxigênio. Portanto, ele será positivo. Agora é só contar quantas ligações o fósforo faz para descobrir seu Nox.
Dessa maneira, percebemos que o fósforo faz cinco ligações com oxigênios e, portanto, seu Nox será de +5.
Questão 06
(Vunesp-SP) As máscaras de oxigênio utilizadas em aviões contêm superóxido de potássio, KO2 sólido. Quando a máscara é usada, o superóxido reage com o CO2(g)
exalado pela pessoa e libera O2(g), necessário à respiração, segundo a equação química balanceada:
Calcule a massa de KO2, expressa em gramas, necessária para
reagir com 0,10 mol de CO2.
a) 284 g
b) 88 g
c) 4,4 g
d) 14,2 g
e) 120 g
Resposta correta: letra d - 14,2 g de KO2.
Para resolver essa questão precisamos lembrar da Lei das proporções definidas de Proust. Como pode ser visto, na equação química 4 mols de KO2(s) reagem com 2 mols de CO2(g) para formar os produtos. Portanto, partiremos dessa proporção para chegar ao valor em gramas de KO2(s), levando em consideração o mol informado no problema (0,10 mol de CO2).
Assim, podemos resolver com regra de três simples, veja:
4 mols de KO2(s) ----------- 2 mols de CO2(g)
x mols de KO2(s) ------------ 0,10 mol de CO2(g)
Realizando os cálculos teremos:
x = 0,20 mol de KO2(s).
Assim, realizamos outros cálculos para chegar ao resultado em gramas. Observe a seguir:
4 mols de KO2(s) ----------- 284 g (Massa obtida na tabela períodica)
0,20 mol de KO2(s) ---------- x g
Dessa maneira, obtermos:
x = 14,2 g de KO2(s) reagindo com CO2(g).
Questão 07
Calcule a quantidade de matéria, em gramas, necessária de hidreto de lítio (LiH) para inflar um bote de capacidade de 380 L. Observe a equação química abaixo:
Observação: CNTP.
a) 22,4 L
b) 135,7 g
c) 280 g
d) 6,9 g
e) 40 g
Resposta correta: letra b - 135,7 g.
Em primeiro lugar, precisamos observar as proporções de Hidreto de Lítio (LiH) para o gás hidrogênio liberado após a reação (H2). A proporção é de 1 para 1, ou seja, 1 mol de LiH produz 1 mol de H2.
Dessa maneira, precisamos lembrar que em Condições Normais de Temperatura e Pressão (CNTP) 1 mol de qualquer substância gasosa possui 22,4 L. Logo, para obter a quantidade de matéria em gramas fazemos uma regra de três simples.
1 mol de LiH --------- 1 mol de H2
Logo,
8 g de LiH ------------- 22,4 L de H2
x g de LiH -------------- 380 L de H2
x = 135,7 g de LiH.
Questão 08
Veja também:
CASTILHO, Rubens. Exercícios de química para 2º ano do ensino médio (com respostas explicadas). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-de-quimica-2-serie/. Acesso em:


