Exercício sobre modelos atômicos (com respostas explicadas)
Teste seus conhecimentos com questões fáceis, médias e difíceis sobre os modelos atômicos propostos por Dalton, Thomson, Rutherford e Niels Bohr.
Questão 1 (nível fácil)
A imagem abaixo representa qual modelo atômico?
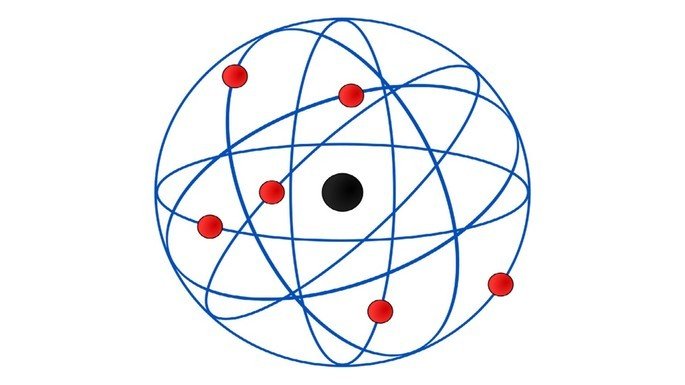
Questão 2 (nível fácil)
Qual cientista propôs o primeiro modelo atômico que ficou conhecido como “bola de bilhar”?
a) Isaac Newton.
b) Demócrito.
c) John Dalton.
d) Ernest Rutherford.
Questão 3 (nível fácil)
Assinale a alternativa incorreta:
a) As primeiras ideias relativas à estrutura interna dos átomos foram de Thomson.
b) No modelo atômico de Rutherford-Bohr, os elétrons giram ao redor do núcleo não ao acaso, mas descrevendo órbitas determinadas.
c) O modelo atômico de Dalton considerava a existência de cargas nos átomos.
d) Demócrito e Leucipo foram os primeiros a definir o conceito de matéria e átomo.
Questão 4 (nível fácil)
Classifique cada uma das afirmações abaixo sobre o modelo atômico de Rutherford como Verdadeira (V) ou Falsa (F), e escolha a alternativa correta.
I. O Modelo Atômico de Rutherford sugere que o átomo se assemelha a um pequeno sistema planetário.
II. O Modelo Atômico de Rutherford ficou conhecido como “modelo pudim de ameixa” ou “pudim com passas” em decorrência da forma que as cargas positivas e negativas são organizadas.
III. No Modelo Atômico de Rutherford, o núcleo é formado pelos prótons e nêutrons e os elétrons orbitam ao seu redor da mesma forma que os planetas giram em torno do Sol.
IV. O Modelo Atômico de Rutherford é também chamado de “Modelo Atômico de Rutherford-Bohr”
a) V, V, V, V
b) F, F, F, F
c) V, F, F, F
d) F, V, F, V
Questão 5 (nível fácil)
Os modelos atômicos descrevem alguns aspectos estruturais dos átomos. Escolha a alternativa correta sobre os modelos atômicos.
a) Os modelos atômicos foram desenvolvidos pelos cientistas gregos Leucipo e Demócrito.
b) Os principais modelos atômicos são: Modelo de Rutherford e o Modelo de Rutherford-Bohr.
c) O primeiro modelo atômico desenvolvido foi o Modelo Atômico de Rutherford.
d) Os modelos atômicos foram desenvolvidos com o intuito de compreender melhor os átomos, suas propriedades e suas influências nos comportamentos da matéria.
Questão 6 (nível médio)
(UFJF-MG) Associe as afirmações a seus respectivos criadores:
I - O átomo não é indivisível e a matéria possui propriedades elétricas (1897).
II - O átomo é uma esfera maciça (1808).
III - O átomo é formado por duas regiões denominadas núcleo e eletrosfera (1911).
a) I - Dalton, II - Rutherford, III - Thomson.
b) I - Thomson, II - Dalton, III - Rutherford.
c) I - Dalton, II - Thomson, III - Rutherford.
d) I - Rutherford, II - Thomson, III - Dalton.
e) I - Thomson, II - Rutherford, III - Dalton.
Questão 7 (nível médio)
(UFRGS) Considere as seguintes afirmações a respeito do experimento de Rutherford e do modelo atômico de Rutherford-Bohr.
I. A maior parte do volume do átomo é constituída pelo núcleo denso e positivo.
II. Os elétrons movimentam-se em órbitas estacionárias ao redor do núcleo.
III. O elétron, ao pular de uma órbita mais externa para uma mais interna, emite uma quantidade de energia bem definida.
Quais estão corretas?
a) Apenas I.
b) Apenas II.
c) Apenas III.
d) Apenas II e III.
e) I, II e III.
Questão 8 (nível médio)
(Vunesp-adaptada) Em 1913, Niels Bohr propôs um modelo para a estrutura dos átomos que explicava a origem dos espectros atômicos. Esse modelo possuía uma série de postulados; entre eles um que estabelecia que a energia do elétron só pode assumir certos valores discretos. Isso os fazia orbitar ao redor do núcleo ocupando apenas as órbitas que continham os níveis de energia permitidos. Considerando esse modelo de Bohr, os diferentes espectros atômicos podem ser explicados em função
a) do recebimento de elétrons por diferentes elementos.
b) da perda de elétrons por diferentes elementos.
c) das diferentes transições eletrônicas, que variam de elemento para elemento.
d) da instabilidade nuclear de diferentes elementos.
Questão 9 (nível médio)
(PUC-RS) A aceitação histórica da ideia de que a matéria é composta de átomos foi lenta e gradual. Na Grécia antiga, Leucipo e Demócrito são lembrados por terem introduzido o conceito de átomo, mas suas propostas foram rejeitadas por outros filósofos e caíram no esquecimento. No final do século XVIII e início do século XIX, quando as ideias de Lavoisier ganhavam aceitação generalizada, surgiu a primeira teoria atômica moderna, proposta por _______. Essa teoria postulava que os elementos eram constituídos de um único tipo de átomo, enquanto que as substâncias compostas eram combinações de diferentes átomos segundo proporções determinadas. Quase cem anos depois, estudos com raios catódicos levaram J. J. Thomson à descoberta do _______, uma partícula de massa muito pequena e carga elétrica _______, presente em todos os materiais conhecidos. Alguns anos depois, por meio de experimentos em que uma fina folha de ouro foi bombardeada com partículas alfa, Rutherford chegou à conclusão de que o átomo possui em seu centro um _______ pequeno, porém de massa considerável.
As palavras que preenchem as lacunas correta e respectivamente estão reunidas em
a) Dalton – elétron – negativa – núcleo
b) Bohr – cátion – positiva – elétron
c) Dalton – nêutron – neutra – próton
d) Bohr – fóton – negativa – ânion
e) Dalton – próton – positiva – núcleo
Questão 10 (nível médio)
(ESPM-SP) O átomo de Rutherford (1911) foi comparado ao sistema planetário (o núcleo atômico representa o sol e a eletrosfera, os planetas):
Eletrosfera é a região do átomo que:
a) contém as partículas de carga elétrica negativa.
b) contém as partículas de carga elétrica positiva.
c) contém nêutrons.
d) concentra praticamente toda a massa do átomo.
e) contém prótons e nêutrons.
Questão 11 (nível difícil)
(Udesc) Considerando os modelos atômicos mais relevantes, dentro de uma perspectiva histórica e científica, assinale a alternativa correta.
a) Até a descoberta da radioatividade, o átomo era tido como indivisível (Dalton). O modelo que o sucedeu foi de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
b) No modelo de Dalton, o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera. O modelo seguinte foi o de Bohr que introduziu a ideia de que os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao modelo do sistema solar.
c) No modelo atômico de Dalton, o átomo era tido como indivisível. O modelo sucessor foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado negativamente e uma eletrosfera.
d) O modelo de Dalton propunha que o átomo era formado por uma massa carregada positivamente com os elétrons distribuídos nela. O modelo seguinte foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera.
e) No modelo atômico de Dalton, os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao do sistema solar. O modelo que o sucedeu foi o de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
Questão 12 (nível difícil)
(FAME) O modelo proposto por Bohr introduziu um único número quântico para descrever o comportamento do elétron no átomo. O modelo da mecânica quântica usa três números quânticos.
Sobre os números quânticos propostos no modelo de Bohr e no modelo da mecânica quântica, é CORRETO afirmar que
a) o modelo atômico de Bohr está relacionado a um número quântico que descreve sobre a orientação dos orbitais.
b) o número quântico azimutal tem valores positivos e inteiros e à medida que esse número quântico aumenta, o orbital torna-se maior.
c) o nível com o número quântico principal n consistirá em n subníveis, e cada subnível corresponde a um valor permitido diferente do número quântico secundário entre 1 e n-1.
d) as energias relativas do elétron nos orbitais do átomo de hidrogênio têm valores diferentes quando o elétron estiver nos orbitais de mesmo subnível.
Questão 13 (nível difícil)
Leia também: Modelos atômicos: quais são e qual é o atual
Confira mais questões com resolução comentada em
- Exercícios sobre o modelo atômico de Dalton (com respostas explicadas)
- Exercícios sobre Modelo Atômico de Bohr (com respostas explicadas)
- Exercício sobre modelo atômico de Rutherford (com gabarito)
- Exercícios sobre átomos (com gabarito resolvido)
- Exercícios sobre estrutura atômica (com gabarito comentado)
SOUTO, Ana. Exercício sobre modelos atômicos (com respostas explicadas). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-modelos-atomicos/. Acesso em:


