Funções Inorgânicas
As funções inorgânicas são os grupos de compostos inorgânicos que apresentam características semelhantes.
Uma classificação fundamental em relação aos compostos químicos é: os compostos orgânicos são aqueles que contêm átomos de carbono, enquanto os compostos inorgânicos são formados pelos demais elementos químicos.
Há exceções como, por exemplo, CO, CO2 e Na2CO3, que embora apresentem o carbono na fórmula estrutural, possuem características de substâncias inorgânicas.
As quatro principais funções inorgânicas são: ácidos, bases, sais e óxidos.
Essas 4 funções principais foram definidas por Arrhenius, químico que identificou íons nos ácidos, nas bases e nos sais.
Ácidos
Ácidos são compostos covalentes, ou seja, que compartilham elétrons nas suas ligações. Eles têm a capacidade de ionizar em água e formar cargas, liberando o H+ como único cátion.
Classificação dos ácidos
Os ácidos podem ser classificados de acordo com a quantidade de hidrogênios que são liberados em solução aquosa e ionizam-se, reagindo com a água formando o íon hidrônio.
| Número de hidrogênios ionizáveis |
|---|
|
Monoácidos: possuem apenas um hidrogênio ionizável. Exemplos: HNO3, HCl e HCN |
|
Diácidos: possuem dois hidrogênios ionizáveis. Exemplos: H2SO4, H2S e H2MnO4 |
|
Triácidos: possuem três hidrogênios ionizáveis. Exemplos: H3PO4 e H3BO3 |
|
Tetrácidos: possuem quatro hidrogênios ionizáveis. Exemplos: H4P7O7 |
A força de um ácido é medida pelo grau de ionização. Quanto maior o valor de mais forte é o ácido, pois:
| Grau de ionização |
|---|
|
Fortes: possuem grau de ionização superior a 50%. |
|
Moderados: possuem grau de ionização entre 5% e 50%. |
|
Fracos: possuem grau de ionização inferior a 5%. |
Os ácidos podem conter ou não o elemento oxigênio na sua estrutura, sendo assim:
| Presença de oxigênio |
|---|
|
Hidrácidos: não apresentam átomos de oxigênio. Exemplos: HCl, HBr e HCN. |
|
Oxiácidos: O elemento oxigênio está presente na estrutura do ácido. Exemplos: HClO, H2CO3 e HNO3. |
Nomenclatura dos ácidos
A fórmula geral de um ácido pode ser descrita como HxA, onde A representa o ânion que compõe o ácido e a nomenclatura gerada pode ser:
| Terminação do ânion | Terminação do ácido |
|---|---|
|
eto Exemplo: Cloreto (Cl-) |
ídrico Exemplo: ácido clorídrico (HCl) |
|
ato Exemplo: clorato |
ico Exemplo: ácido clórico (HClO3) |
|
ito Exemplo: nitrito |
oso Exemplo: ácido nitroso (HNO2) |
Características dos ácidos
As principais características dos ácidos são:
- Têm sabor azedo.
- Conduzem corrente elétricas, pois são soluções eletrolíticas.
- Formam o gás hidrogênio quando reagem com metais, como magnésio e zinco.
- Formam gás carbônico ao reagir com carbonato de cálcio.
- Alteram para uma cor específica os indiciadores ácido-base (papel de tornassol azul fica vermelho).
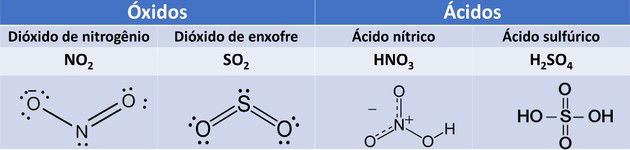
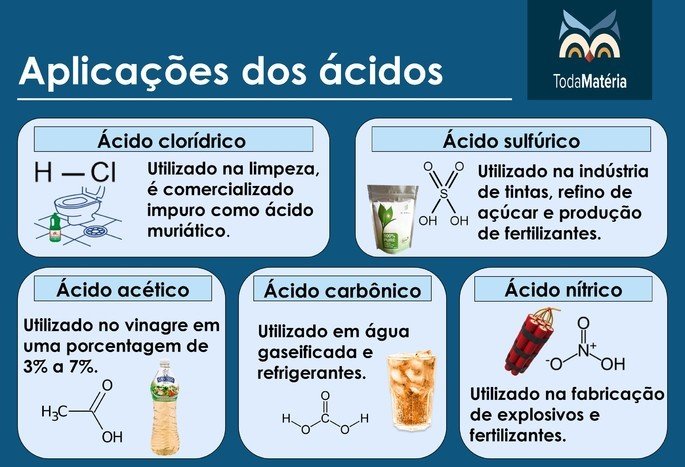
Principais ácidos
Exemplos: acido clorídrico (HCl), ácido sulfúrico (H2SO4), ácido acético (CH3COOH), ácido carbônico (H2CO3) e ácido nítrico (HNO3).
Embora o ácido acético seja um ácido da Química Orgânica, é importante conhecer a sua estrutura devido a sua importância.
Veja também: Nomenclatura dos ácidos.
Bases
Bases são compostos iônicos formados por cátions, na maioria das vezes de metais, que se dissociam em água liberando o ânion hidróxido (OH-).
Classificação das bases
As bases podem ser classificadas de acordo com o número de hidroxilas liberadas em solução.
| Número de hidroxilas |
|---|
|
Monobases: possuem apenas uma hidroxila. Exemplos: NaOH, KOH e NH4OH |
|
Dibases: possuem duas hidroxilas. Exemplos: Ca(OH)2, Fe(OH)2 e Mg(OH)2 |
|
Tribases: possuem três hidroxilas. Exemplos: Al(OH)3 e Fe(OH)3 |
|
Tetrabases: possuem quatro hidroxilas. Exemplos: Sn(OH)4 e Pb(OH)4 |
As bases geralmente são substâncias iônicas e a força de uma base é medida pelo grau de dissociação.
Quanto maior o valor de mais forte é a base, pois:
| Grau de dissociação |
|---|
|
Fortes: possuem grau de dissociação praticamente 100%. Exemplos:
|
|
Fracos: possuem grau de dissociação inferior a 5%. Exemplo: NH4OH e Zn(OH)2. |
| Solubilidade em água |
|---|
|
Solúveis: bases de metais alcalinos e amônio. Exemplos: Ca(OH)2, Ba(OH)2 e NH4OH. |
|
Pouco solúveis: bases de metais alcalinos terrosos. Exemplos: Ca(OH)2 e Ba(OH)2. |
|
Praticamente insolúveis: demais bases. Exemplos: AgOH e Al(OH)3. |
Nomenclatura das bases
A fórmula geral de uma base pode ser descrita como , onde B representa o radical positivo que compõe a base e y é a carga que determina o número de hidroxilas.
A nomenclatura para bases com carga fixa é dada por:
| Bases com carga fixa | ||
|---|---|---|
|
Metais alcalinos |
Hidróxido de lítio |
LiOH |
| Metais alcalinos terrosos |
Hidróxido de magnésio |
Mg(OH)2 |
|
Prata |
Hidróxido de prata |
AgOH |
| Zinco | Hidróxido de zinco | Zn(OH)2 |
| Alumínio | Hidróxido de alumínio | Al(OH)3 |
Quando a base tem carga variável a nomenclatura pode ser de duas formas:
| Bases com carga variável | |||
|---|---|---|---|
| Cobre | Cu+ | Hidróxido de cobre I | CuOH |
| Hidróxido cuproso | |||
| Cu2+ | Hidróxido de cobre II | Cu(OH)2 | |
| Hidróxido cúprico | |||
| Ferro | Fe2+ | Hidróxido de ferro II | Fe(OH)2 |
| Hidróxido ferroso | |||
| Fe3+ | Hidróxido de ferro III | Fe(OH)3 | |
| Hidróxido férrico | |||
Características das bases
- A maioria das bases são insolúveis em água.
- Conduzem corrente elétrica em solução aquosa.
- São escorregadias.
- Reagem com ácido formando sal e água como produtos.
- Alteram para uma cor específica os indiciadores ácido-base (papel de tornassol vermelho fica azul).
Principais bases
As bases são muito utilizadas em produtos de limpeza e também em processos das indústrias químicas.
Exemplos: hidróxido de sódio (NaOH), hidróxido de magnésio (Mg(OH)2), hidróxido de amônio (NH4OH), hidróxido de alumínio (Al(OH)3) e hidróxido de cálcio (Ca(OH)2).

Sais
Sais são compostos iônicos que apresentam, no mínimo, um cátion diferente de H+ e um ânion diferente de OH-.
Um sal pode ser obtido em uma reação de neutralização, que é a reação entre um ácido e uma base.
A reação do ácido clorídrico com hidróxido de sódio produz cloreto de sódio e água.
O sal formado é composto pelo ânion do ácido (Cl-) e pelo cátion da base (Na+).
Classificação dos sais
A seguir, temos as principais famílias de sais que podem ser classificadas de acordo com a solubilidade em água e alteração do pH da solução da seguinte forma:
| Solubilidade em água dos sais mais comuns | |||
|---|---|---|---|
| Solúveis | Nitratos | Exceções: Acetato de prata. |
|
| Cloratos | |||
|
Acetatos |
|
||
| Cloretos | Exceções: |
||
| Brometos | |||
| Iodetos | |||
| Sulfatos |
Exceções: |
||
| Insolúveis | Sulfetos |
Exceções: alcalino-terrosos e amônio. |
|
| Carbonatos | Exceções: Os de metais alcalinos e amônio. |
||
| Fosfatos | |||
| pH | |
|---|---|
| Sais neutros |
Quando são dissolvidos em água não alteram o pH. Exemplo: NaCl. |
| Sais ácidos |
Quando são dissolvidos em água fazem o pH da solução ficar menor que 7. Exemplo: NH4Cl. |
| Sais básicos |
Quando são dissolvidos em água fazem o pH da solução ficar maior que 7. Exemplo: CH3COONa. |
Além das famílias de sais que vimos anteriormente, existem outros tipos de sais, conforme a tabela a seguir.
| Outros tipos de sais | |
|---|---|
| Hidrogeno-sais | Exemplo: NaHCO3 |
| Hidroxi-sais | Exemplo: Al(OH)2Cl |
| Sais duplos | Exemplo: KNaSO4 |
| Sais hidratados | Exemplo: CuSO4 . 5 H2O |
| Sais complexos | Exemplo: [Cu(NH3)4]SO4 |
Nomenclatura dos sais
De maneira geral, a nomenclatura de um sal segue a seguinte ordem:
| Nome do ânion | Nome de cátion | Nome do sal |
|---|---|---|
|
Cl- Cloreto |
Fe3+ Ferro III |
FeCl3 Cloreto de ferro III |
|
Sulfato |
Na+ Sódio |
Na2SO4 Sulfato de sódio |
|
Nitrito |
K+ Potássio |
KNO2 Nitrito de potássio |
|
Br- Brometo |
Ca2+ Cálcio |
CaBr2 Brometo de cálcio |
Características dos sais
- São compostos iônicos.
- São sólidos e cristalinos.
- Sofrem ebulição em temperaturas altas.
- Conduzem corrente elétrica em solução.
- Têm sabor salgado.
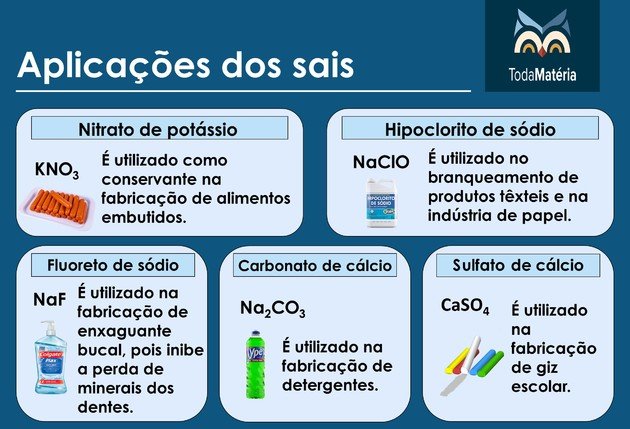
Principais sais
Exemplos: nitrato de potássio (KNO3), hipoclorito de sódio (NaClO), fluoreto de sódio (NaF), carbonato de sódio (Na2CO3) e sulfato de cálcio (CaSO4).
Óxidos
Óxidos são compostos binários (iônicos ou moleculares), que têm dois elementos. Possuem oxigênio na sua composição, sendo ele o seu elemento mais eletronegativo.
A fórmula geral de um óxido é , onde C é o cátion e sua carga y se transforma em índice no óxido formando o composto:
Classificação dos óxidos
| De acordo com as ligações químicas | |
|---|---|
| Iônicos |
Combinação do oxigênio com metais. Exemplo: ZnO. |
| Moleculares |
Combinação do oxigênio com elementos não metálicos. Exemplo: SO2. |
| De acordo com as propriedades | |
|---|---|
| Básicos |
Em solução aquosa alteram o pH para maior que 7. Exemplo: Li2O ( e demais metais alcalinos e alcalinos terrosos). |
| Ácidos |
Em solução aquosa reagem com a água e formam ácidos. Exemplos: CO2, SO3 e NO2. |
| Neutros |
Alguns óxidos que não reagem com a água. Exemplo: CO. |
| Peróxidos |
Em solução aquosa reagem com a água ou ácidos diluídos e formam água oxigenada H2O2. Exemplo: Na2O2. |
| Anfóteros |
Podem se comportar como ácidos ou bases. Exemplo: ZnO. |
Nomenclatura dos óxidos
De maneira geral, a nomenclatura de um óxido segue a seguinte ordem:
| Nome de acordo com tipo de óxido | |
|---|---|
| Óxidos iônicos |
Exemplos de óxidos com carga fixa: CaO - Óxido de cálcio Al2O3 - Óxido de alumínio |
|
Exemplos de óxidos com carga varável: FeO - Óxido de ferro II Fe2O3 - Óxido de ferro III |
|
| Óxidos moleculares |
Exemplos: CO - Monóxido de carbono N2O5 - Pentóxido de dinitrogênio |
Características dos óxidos
- São substâncias binárias.
- São formados pela ligação do oxigênio com outros elementos, exceto o flúor.
- Óxidos metálicos, ao reagir com ácidos, formam sal e água.
- Óxidos não metálicos, ao reagir com bases, formam sal e água.
Principais óxidos
Exemplos: óxido de cálcio (CaO), óxido de manganês (MnO2), óxido de estanho (SnO2), óxido de ferro III (Fe2O3) e óxido de alumínio (Al2CO3).

Pratique com Exercício sobre óxidos (com gabarito respondido).
Exercícios de Vestibular
1. (UEMA/2015) O NO2e o SO2 são gases causadores de poluição atmosférica que, dentre os danos provocados, resulta na formação da chuva ácida quando esses gases reagem com as partículas de água presentes nas nuvens, produzindo HNO3 e H2SO4.
Esses compostos, ao serem carregados pela precipitação atmosférica, geram transtornos, tais como contaminação da água potável, corrosão de veículos, de monumentos históricos etc.
Os compostos inorgânicos citados no texto correspondem, respectivamente, às funções:
a) sais e óxidos
b) bases e sais
c) ácidos e bases
d) bases e óxidos
e) óxidos e ácidos
2. (UNEMAT/2012) Fazemos uso de vários produtos químicos no nosso cotidiano, como por exemplo, leite de magnésio, vinagre, calcário e soda cáustica.
É correto afirmar que estas substâncias citadas pertencem, respectivamente, às funções químicas:
a) ácido, base, sal e base
b) base, sal, ácido e base
c) base, ácido, sal e base
d) ácido, base, base e sal
e) sal, ácido, sal e base
3. (UDESC/2008) Com relação ao ácido clorídrico, pode-se afirmar que:
a) quando está em solução aquosa permite a passagem de corrente elétrica
b) é um diácido
c) é um ácido fraco
d) possui baixo grau de ionização
e) é uma substância iônica
Para mais questões com resolução comentada, veja também:
BATISTA, Carolina. Funções Inorgânicas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/funcoes-inorganicas/. Acesso em: