Conceito e determinação de pH e pOH
pH representa o potencial hidrogeniônico e pOH é o potencial hidroxiliônico das soluções.
Tratam-se de escalas logarítmicas utilizadas para medir o caráter ácido e básico de uma amostra.
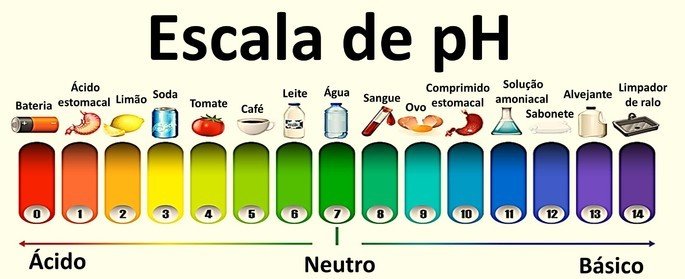
Os valores que as compõem variam de 0 a 14 e foram obtidos a partir do equilíbrio iônico da água.
Uma solução neutra tem pH igual a 7. Os valores abaixo de 7 classificam as soluções em ácidas, enquanto que após o 7 as soluções são básicas.
De posse do valor de pH é possível descobrir o correspondente na escala de pOH, apenas fazendo uma subtração.
Equilíbrio iônico da água
Uma molécula de água tem a capacidade de se ionizar conforme a equação:
Temos aqui um equilíbrio iônico, pois o processo é reversível e os íons também podem se unir e formar novamente uma molécula de água.
Outra forma de demonstrar o equilíbrio que ocorre é através da autoionização.
Uma molécula de água gerou íons hidrônio (H3O+) e hidroxila (OH-) através da ruptura de uma segunda molécula.
Produto iônico da água (Kw)
A constante para o equilíbrio iônico da água é:
Como a água é um líquido puro, sua concentração é tida como 1 e não interfere no valor da constante. Sendo assim, a expressão se torna:
O produto iônico da água é .
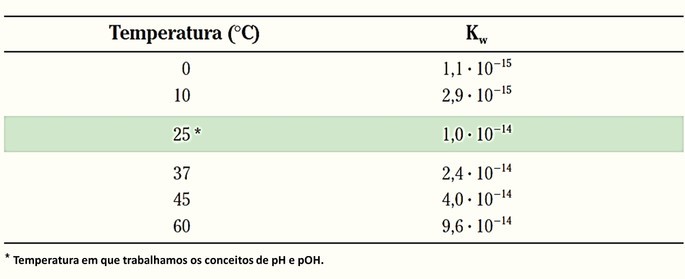
Essa expressão recebe o símbolo Kw (W vem da palavra água em inglês - water) e assim como a constante de equilíbrio, varia conforme a temperatura.
Determinação de pH e pOH
Na temperatura de 25 ºC temos que o produto iônico da água é:
Na ionização da água pura, 1 mol de H3O+ é formado com 1 mol de OH- .
Logo,
Como esses valores são extremamente baixos, decidiu-se utilizar os valores de cologaritmos, que correspondem ao logaritmo com sinal trocado.
Aplicando-se o cologaritmo no produto iônico da água, temos que:
Podemos observar que: se conhecermos o pH de uma solução, o valor de pOH pode ser encontrado subtraindo de 14 o primeiro valor.
Acidez e basicidade das soluções
Solução neutra: a concentração de íons hidrônio é igual a de hidroxilas.
| [H3O+] = 1,0 . 10-7 mol/L | pH = 7 |
| [OH-] = 1,0 . 10-7 mol/L | pOH = 7 |
Exemplo: água pura.
Solução ácida: a concentração de íons hidrônio é maior que de hidroxilas.
| [H3O+] |
pH |
| [OH-] |
pOH |
Exemplo: refrigerante, limão e tomate.
Solução básica: a concentração de hidroxilas é maior que de íons hidrônio.
| [H3O+] |
pH |
| [OH-] |
pOH |
Exemplo: ovo, sabonete e alvejante.
Cálculo de pH
O conceito de potencial hidrogeniônico foi criado pelo químico dinamarquês Peter Lauritz Sorensen (1868-1939) para expressar a acidez de uma solução por meio da concentração de H+.
Veja a tabela a seguir demonstrando a ionização de um ácido:
| Molaridade inicial | 0,020 | 0 | 0 |
| Ionização | 0,001 | 0,001 | 0,001 |
| Molaridade no equilíbrio | 0,019 | 0,001 | 0,001 |
No exemplo temos que a concentração de íons H+ é 0,001. Sendo assim, o pH da solução é:
[H+] = 0,001 = 10-3
pH = - log 10-3 = 3
Como o pH da solução é menor que 7, essa solução é ácida.
Resumo sobre pH e pOH
| Definições | pH: potencial hidrogeniônico da solução. | |
|---|---|---|
| pOH: potencial hidroxiliônico da solução. | ||
| Fórmula geral | pH + pOH = 14 | |
| Soluções | Neutras | pH = pOH = 7 |
| Ácidas |
pH < 7 pOH > 7 |
|
| Básicas |
pOH < 7 pH > 7 |
|
| Cálculo de pH | pH = - log [H+] | |
| Cálculo de pOH | pOH = - log [OH-] | |
Exercícios sobre pH e pOH
1. (FMTM) O pH do suco gástrico, uma solução aquosa de ácido clorídrico (HCℓ), é, aproximadamente, 2. Portanto, a massa, em gramas, de HCℓ existente em cada litro de suco gástrico, é
Dados: Massas molares (g/mol) H = 1, Cℓ = 35,5
a) 7,3 · 10-2
b) 3,65 · 10-1
c) 10-2
d) 2
e) 10
2. (UEMG) Vários produtos de limpeza apresentam amônia em sua constituição. O rótulo de um desses produtos indica pH = 11. Isso significa que a concentração de cátions hidroxônio e a de ânions hidroxila nesse produto são, respectivamente:
a) 1 . 10-3 e 1 . 10-11
b) 1 . 10-11 e 1 . 10-7
c) 1 . 10-11 e 1 . 10-3
d) 1 . 10-11 e 1 . 10-11
3. (UFRGS) Qual das soluções aquosas a seguir apresenta o pH mais elevado?
a) NaOH 0,1 mol/L
b) NaCl 0,5 mol/L
c) H2SO4 1,0 mol/L
d) HCl 1,0 mol/L
e) KOH 0,2 mol/L
Para mais questões, com resolução comentada, não deixe de conferir: Exercícios sobre pH e pOH.
BATISTA, Carolina. Conceito e determinação de pH e pOH. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/ph-e-poh/. Acesso em:


