Pressão osmótica
A pressão osmótica é uma propriedade coligativa que corresponde a pressão que deve ser exercida em um sistema para impedir que a osmose ocorra espontaneamente.
A osmose é a passagem de água de um meio menos concentrado (hipotônico) para outro mais concentrado (hipertônico), através de uma membrana semipermeável, até que se atinja o equilíbrio.
Para impedir que a osmose se inicie e aconteça naturalmente, é necessário aplicar uma pressão externa sobre a solução mais concentrada, impedindo a passagem do solvente para o meio mais concentrado. Essa é a pressão osmótica.
Quanto mais concentrada for a solução, maior deverá ser a pressão osmótica. Logo, a pressão osmótica é proporcional a concentração do soluto.
Como calcular a pressão osmótica?
Cada solução possui um valor de pressão osmótica diferente. A pressão osmótica pode ser calculada a partir da seguinte fórmula:
π = M . R . T . i
Onde, temos as seguintes variáveis:
π = pressão osmótica;
M = concentração em mol/L;
R = constante universal dos gases, cujo valor corresponde a 0,082 atm . L. mol-1. K-1 ou 62,3 mm Hg L. mol-1. K-1;
T = temperatura na escala absoluta (Kelvin);
i = fator de Van’t Hoff, que compreende a relação entre o total de partículas finais e iniciais em soluções iônicas.
Exercício resolvido
1. (Puccamp-SP) Eventualmente, a solução 0,30 M de glicose é utilizada em injeção intravenosa, pois tem pressão osmótica próxima à do sangue. Qual é a pressão osmótica, em atmosferas, da referida solução a 37 ºC?
a) 1,00.
b) 1,50.
c) 1,76.
d) 7,63.
e) 9,83.
Considerando os dados fornecidos pela questão, temos:
M = 0,30 mol/L;
R = 0,082 atm. L. mol-1. K-1
T = 37° + 273 = 310 K
Agora, você deve aplicar esses valores na fórmula do cálculo da pressão osmótica:
π = M . R . T . i
π = 0,30 . 0,082 . 310
π = 7,63 atm (Alternativa d)
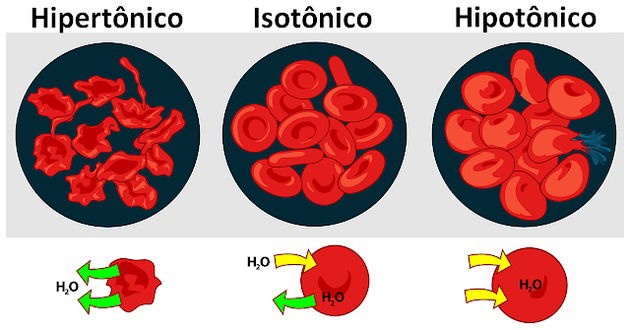
Classificação das soluções
As soluções podem ser classificadas em três tipos, conforme a pressão osmótica:
- Solução hipertônica: Possui maior pressão osmótica e concentração de soluto.
- Solução isotônica: Quando as soluções possuem a mesma pressão osmótica.
- Solução hipotônica: Possui menor pressão osmótica e concentração de soluto.
A importância da pressão osmótica para os seres vivos
O soro fisiológico é uma substância preparada com base nos princípios da pressão osmótica. Ele deve ser aplicado em pressão osmótica igual a encontrada no corpo, isso evita que as hemácias não sofram hemólise ou fiquem murchadas.
A pressão osmótica do sangue é de aproximadamente 7,8 atm. Logo, para o funcionamento correto do organismo, as hemácias devem possuir a mesma pressão osmótica, garantindo o fluxo normal de água para dentro e fora das células.
Em casos de desidratação, por exemplo, é indicado o uso de soro fisiológico, o qual deve ser isotônico em relação às células sanguíneas e outros líquidos corporais.
O soro fisiológico tem como função retornar o equilíbrio osmótico do interior do organismo. Isso porque durante a desidratação, o sangue torna-se mais concentrado do que o interior das células, fazendo com que elas murchem.
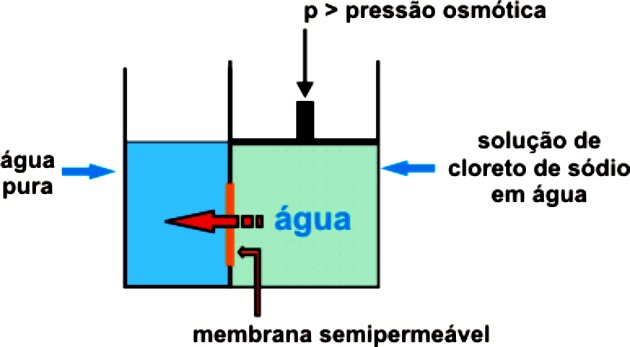
Osmose e Osmose Reversa
Como vimos, a osmose é processo de passagem da água do meio hipotônico para o meio hipertônico, através de uma membrana semipermeável, até que se atinja o equilíbrio entre as concentrações.
Enquanto isso, a osmose reversa é um processo de separação de substâncias através de uma membrana que retém o soluto. O solvente flui do meio mais concentrado para o menos concentrado e isola-se do soluto, por uma membrana que permite a sua passagem.
Isso só acontece devido à pressão exercida, fazendo com que a membrana semipermeável permita apenas a passagem da água, retendo o soluto. Essa pressão deve ser maior do que a pressão osmótica natural.
Por exemplo, se a pressão osmótica aplicada for maior do que o necessário, ocorrerá a osmose reversa. Assim, a passagem do fluxo será do meio de maior concentração para o de menor concentração.
MAGALHÃES, Lana. Pressão osmótica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/pressao-osmotica/. Acesso em:


