Princípio de Le Chatelier
O químico francês Henri Louis Le Chatelier criou uma das leis mais conhecidas da Química que prevê a resposta do sistema químico em equilíbrio quando exposto a uma alteração.
Com os resultados dos seus estudos, ele formulou uma generalização para o equilíbrio químico que enuncia o seguinte:
“Quando um fator externo age sobre um sistema em equilíbrio, este se desloca, sempre no sentido de minimizar a ação do fator aplicado.”
Quando o equilíbrio de um sistema químico é perturbado, o sistema age para minimizar essa perturbação e voltar a estabilidade.
Sendo assim, o sistema apresenta:
- um estado inicial de equilíbrio.
- um estado "não equilibrado" com a mudança de um fator.
- um novo estado de equilíbrio que se opõe a mudança.
São exemplos de pertubações externas que podem afetar o equilíbrio químico:
| Fator | Perturbação | Efeito |
|---|---|---|
| Concentração | Aumento | Consome-se a substância |
| Diminuição | Produz-se a substância | |
| Pressão | Aumento | Move-se para o menor volume |
| Diminuição | Move-se para o maior volume | |
| Temperatura | Aumento | Absorve-se calor e altera a constante de equilíbrio |
| Diminuição | Libera-se calor e altera a constante de equilíbrio | |
| Catalisador | Presença | Acelera-se a reação |
Esse princípio tem grande importância para indústria química, pois as reações podem ser manipuladas e tornar os processos mais eficientes e econômicos.
Um exemplo disso é o processo desenvolvido por Fritz Haber, que utilizando o princípio de Le Chatelier, criou de forma econômica uma rota de produção de amônia a partir de nitrogênio atmosférico.
A seguir, analisaremos o equilíbrio químico segundo a lei de Chatelier e como as perturbações podem alterá-lo.
Saiba mais sobre:
Efeito da concentração
Quando há um equilíbrio químico, o sistema está balanceado.
O sistema em equilíbrio pode sofrer uma perturbação quando:
- Aumentamos a concentração de um componente da reação.
- Diminuímos a concentração de um componente da reação.
Ao adicionarmos ou removermos uma substância da reação química, o sistema se opõe a mudança, consumindo ou produzindo mais desse composto, de forma que o equilíbrio seja restabelecido.
As concentrações dos reagentes e produtos mudam para se adaptarem a um novo equilíbrio, mas a constante de equilíbrio permanece igual.
Exemplo:
No equilíbrio:
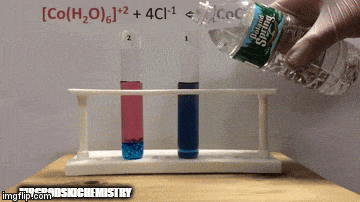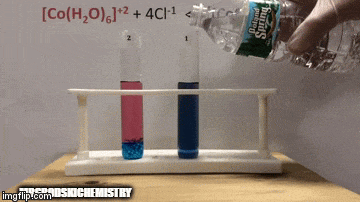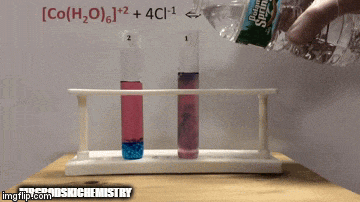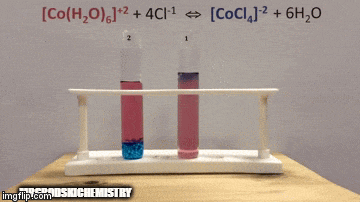
A reação está com uma maior concentração de produtos, pois pela coloração azul da solução vemos que o complexo [CoCl4]-2 predomina.
A água também é um produto da reação direta e quando aumentamos a sua concentração na solução, o sistema se opõe a mudança, fazendo com que a água e o complexo reajam.
O equilíbrio é deslocado para esquerda, sentido da reação inversa, e faz com que aumente a concentração de reagentes, mudando a cor da da solução.
Efeito da temperatura
O sistema em equilíbrio pode sofrer uma perturbação quando:
- Há um aumento da temperatura do sistema.
- Há uma diminuição da temperatura do sistema.
Ao adicionarmos ou removermos energia de um sistema químico, o sistema se opõe a mudança, absorvendo ou liberando energia, de forma que o equilíbrio seja restabelecido.
Quando o sistema varia a temperatura, o equilíbrio químico se desloca da seguinte forma:
Aumentando a temperatura, a reação endotérmica é favorecida e o sistema absorve calor.
Já quando se diminui a temperatura, a reação exotérmica é favorecida e o sistema libera calor.
Exemplo:
No equilíbrio químico:
Quando colocamos o tubo de ensaio contendo esse sistema em um béquer com água quente, a temperatura do sistema aumenta e o equilíbrio se desloca formando mais produtos.

Isso ocorre porque a reação direta é endotérmica e o sistema vai ser restabelecido absorvendo calor.
Além disso, as variações de temperatura alteram também as constantes de equilíbrio.
Efeito da pressão
O sistema em equilíbrio pode sofrer uma perturbação quando:
- Há um aumento da pressão total do sistema.
- Há uma diminuição da pressão total do sistema.
Ao aumentarmos ou diminuirmos a pressão de um sistema químico, o sistema se opõe a mudança, deslocando o equilíbrio no sentido de menor ou maior volume respectivamente, mas não altera a constante de equilíbrio.
Quando o sistema varia o volume, minimiza a ação da pressão aplicada, da seguinte forma:
Quanto maior a pressão aplicada ao sistema, haverá uma contração do volume e o equilíbrio se desloca para o sentido de menor número de mols.
Entretanto, se a pressão diminuir o sistema se expande, aumentando o volume e o sentido da reação é deslocado para o de maior número de mols.
Exemplo:
As células do nosso corpo recebem o oxigênio por meio do equilíbrio químico:
Esse sistema é estabelecido quando o oxigênio do ar que respiramos entra em contato com a hemoglobina presente no sangue, dando origem à oxi-hemoglobina, que transporta o oxigênio.
Quando uma pessoa escala uma montanha, quanto maior a altitude alcançada, menor a quantidade e pressão parcial de O2 no ar.
O equilíbrio que transporta oxigênio no corpo, se desloca para esquerda e reduz a quantidade de oxi-hemoglobina, comprometendo a quantidade de oxigênio recebida pelas células.
O resultado disso é o aparecimento de tonturas e fadiga, podendo até levar à morte.
O corpo tenta reagir produzindo mais hemoglobina. Entretanto, esse é um processo lento, que exige ambientação a altitude.

Por isso, as pessoas que conseguem escalar o monte Everest são as que melhor se adaptam a altitude extrema.
Catalisadores
O uso de catalisador interfere na velocidade da reação, tanto na reação direta quanto na inversa.
Para ocorrer uma reação, é necessário atingir uma energia mínima para que as moléculas se choquem e reajam de maneira efetiva.
O catalisador, ao ser inserido no sistema químico, age diminuindo essa energia de ativação por formar um complexo ativado e cria um menor caminho para atingir o equilíbrio químico.
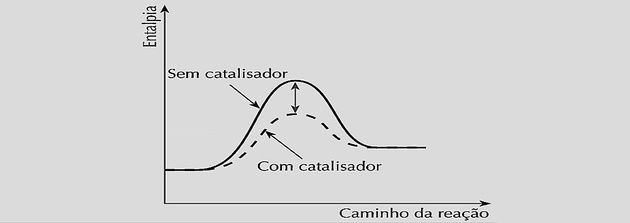
Ao aumentar por igual as velocidades das reações, ele diminui o tempo necessário para se atingir o equilíbrio, como podemos observar nos gráficos a seguir:
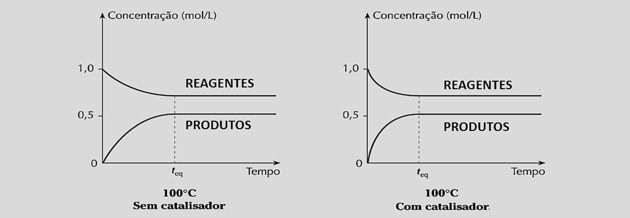
Entretanto, o uso de catalisadores não altera o rendimento da reação nem a constante de equilíbrio porque não interfere na composição da mistura.
Síntese da amônia
Os compostos a base de nitrogênio são amplamente utilizados em adubos agrícolas, explosivos, medicamentos, entre outros. Devido a esse fato, tem-se a produção de milhões de toneladas de compostos nitrogenados, como amônia NH3, nitrato de amônio NH4NO3 e ureia H2NCONH2.
Devido a demanda mundial de compostos nitrogenados, principalmente para as atividades agrícolas, o salitre do Chile NaNO3, principal fonte de compostos nitrogenados, era o mais utilizado até o início do século XX, mas o salitre natural não seria capaz de suprir a demanda atual.
É interessante notar que, o ar atmosférico é uma mistura de gases, composto de mais de 70% de nitrogênio N2. Porém, devido a estabilidade da ligação tripla torna-se um processo muito difícil romper essa ligação para formação de novos compostos.
A solução para esse problema foi proposta pelo químico alemão Fritz Haber. A síntese da amônia proposta por Haber traz o seguinte equilíbrio químico:
Para ser implementado industrialmente, esse processo foi aperfeiçoado por Carl Bosch e é o mais utilizado até hoje para captação do nitrogênio do ar com foco na obtenção de compostos nitrogenados.
Utilizando o princípio de Le Chatelier, o equilíbrio químico pode ter seu rendimento aumentado quando:
Adiciona-se H2 e faz com que o sistema se oponha a mudança e reaja para diminuir a concentração desse reagente.
Dessa forma, H2 e N2 são consumidos simultaneamente para produzir mais produto e criar um novo estado de equilíbrio.
Da mesma forma, ao adicionar mais nitrogênio, o equilíbrio é deslocado para direita.
Industrialmente, o equilíbrio é deslocado pela remoção continua de NH3 do sistema por meio de liquefação seletiva, aumentando o rendimento da reação, pois o equilíbrio para ser restabelecido tende a formar mais produto.
A síntese de Haber-Bosch é uma das mais importantes aplicações dos estudos do equilíbrio químico.
Devido a relevância dessa síntese, Haber recebeu o Prêmio Nobel de Química em 1918 e Bosch foi agraciado com o Prêmio em 1931.
Exercícios sobre deslocamento de equilíbrio
Agora que você já sabe interpretar as mudanças que podem ocorrer no equilíbrio químico, utilize essas questões de vestibulares para testar seus conhecimentos.
1. (UFPE) Os antiácidos mais indicados devem ser aqueles que não reduzam demais a acidez no estômago. Quando a redução da acidez é muito grande, o estômago secreta excesso de ácido. Esse efeito é conhecido como a “revanche ácida”. Qual dos itens abaixo poderia ser associado a esse efeito?
a) A lei da conservação da energia.
b) O princípio da exclusão de Pauli.
c) O princípio de Le Chatelier.
d) O primeiro princípio da Termodinâmica.
e) O princípio da incerteza de Heisenberg.
2. (UFMG) O hidrogênio molecular pode ser obtido, industrialmente, pelo tratamento do metano com vapor de água. O processo envolve a seguinte reação endotérmica
Com relação ao sistema em equilíbrio, pode-se afirmar, corretamente, que:
a) a presença de um catalisador afeta a composição da mistura.
b) a presença de um catalisador afeta a constante de equilíbrio.
c) o aumento da pressão diminui a quantidade de CH4(g).
d) o aumento da temperatura afeta a constante de equilíbrio.
e) o aumento da temperatura diminui a quantidade de CO(g) .
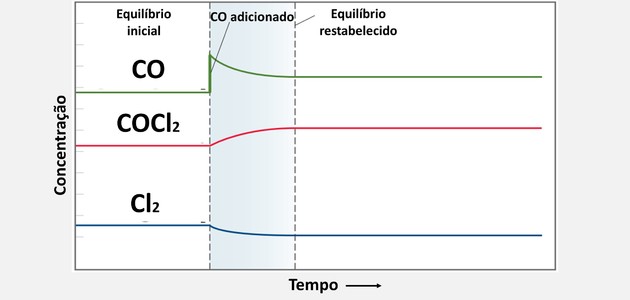
3. (UFC) No estudo da ação do gás venenoso COCl2 , usado como arma química, observa-se o processo de decomposição do mesmo de acordo com a reação:
Partindo de uma situação de equilíbrio, adicionou-se 0,10 mol de CO e o sistema, após algum tempo, chegou a uma nova situação de equilíbrio. Escolha a opção que indica como as novas concentrações do equilíbrio estão relacionadas com as antigas.
| [COCl2] | [CO] | [Cl2] | |
| a) | nova > antiga | nova > antiga | nova < antiga |
| b) | nova > antiga | nova > antiga | nova > antiga |
| c) | nova < antiga | nova > antiga | nova < antiga |
| d) | nova > antiga | nova < antiga | nova < antiga |
| e) | mesma | mesma | mesma |
4. (UFV) O estudo experimental de uma reação química em equilíbrio demonstrou que o aumento da temperatura favorecia a formação de produtos, enquanto que o aumento da pressão favorecia a formação de reagentes. Baseado nessas informações, e sabendo que A, B, C e D são gases, assinale a alternativa que representa a equação estudada:
| a) | ||
| b) | ||
| c) | ||
| d) | ||
| e) |
5. (UEMG) As equações a seguir representam sistemas em equilíbrio. Qual o único sistema que não se desloca por alteração de pressão?
a) SO2(g) + 1/2 O2(g) ⇔ SO3(g)
b) CO2(g) + H2(g) ⇔ CO(g) + H2O(g)
c) N2(g) + 3 H2(g) ⇔ 2 NH3(g)
d) 2 CO2(g) ⇔ 2 CO(g) + O2(g)
Confira mais questões sobre deslocamento de equilíbrio químico, com resolução comentada, nessa lista que preparamos: exercícios de equilíbrio químico.
Quem foi Le Chatelier?

BATISTA, Carolina. Princípio de Le Chatelier. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/principio-de-le-chatelier/. Acesso em: