Propriedades Coligativas
As propriedades coligativas envolvem os estudos sobre as propriedades físicas das soluções, mais precisamente de um solvente em presença de um soluto.
Ainda que não seja de nosso conhecimento, as propriedades coligativas são muito utilizadas em processos industriais e mesmo em diversas situações cotidianas.
Relacionados a essas propriedades estão as constantes físicas, por exemplo, a temperatura de ebulição ou de fusão de determinadas substâncias.
Como exemplo, podemos citar o processo da indústria do automóvel, como a adição de aditivos nos radiadores dos carros. Isso explica porque em locais mais gélidos, a água presente no radiador não congela.
Processos realizados com alimentos, como o salgamento de carnes ou mesmo os alimentos saturados em açúcar, evitam a deterioração e proliferação de organismos.
Além disso, a dessalinização da água (retirada de sal) bem como o espalhamento de sal na neve em locais onde o inverno é muito rigoroso, corroboram a importância do conhecimento dos efeitos coligativos nas soluções.
Quer saber mais sobre os conceitos relacionados com as propriedades coligativas? Leia os artigos:
- Estados Físicos da Água
- Ponto de Fusão e Ponto de Ebulição
- Dessalinização da Água
- Separação de Misturas
Solvente e Soluto
Antes de mais nada, devemos nos atentar aos conceitos de solvente e soluto, ambos componentes de uma solução:
- Solvente: substância que dissolve.
- Soluto: substância dissolvida.
Como exemplo, podemos pensar numa solução de água com sal, onde a água representa o solvente e o sal, o soluto.
Quer saber mais? Leia também Solubilidade.
Efeitos Coligativos: Tipos de Propriedades Coligativas
Os efeitos coligativos estão associados aos fenômenos que ocorrem com os solutos e solventes de uma solução, sendo classificados em:
Efeito Tonométrico
A tonoscopia, também chamada de tonometria, é um fenômeno que se observa quando ocorre a diminuição da pressão máxima de vapor de um líquido (solvente).
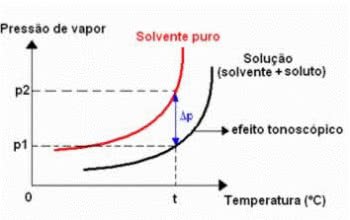
Gráfico do Efeito Tonométrico
Isso ocorre por meio da dissolução de um soluto não-volátil. Sendo assim, o soluto diminui a capacidade de evaporação do solvente.
Esse tipo de efeito coligativo pode ser calculado pela seguinte expressão:
Δp = p0 – p
Onde,
Δp: abaixamento absoluto da pressão máxima de vapor a solução
p0: pressão máxima de vapor do líquido puro, à temperatura t
p: pressão máxima de vapor da solução, à temperatura t
Efeito Ebuliométrico
A ebulioscopia, também chamada de ebuliometria, é um fenômeno que contribui para o aumento da variação de temperatura de um líquido durante o processo de ebulição.
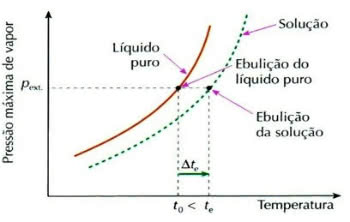
Gráfico do Efeito Ebuliométrico
Isso ocorre por meio da dissolução de um soluto não-volátil, por exemplo, quando acrescentamos açúcar na água que está prestes a entrar em ebulição, a temperatura de ebulição do líquido aumenta.
O chamado efeito ebuliométrico (ou ebulioscópico) é calculado pela seguinte expressão:
Δte = te – t0
Onde,
Δte: elevação da temperatura de ebulição da solução
te: temperatura inicial de ebulição da solução
t0: temperatura de ebulição do líquido puro
Efeito Criométrico
A crioscopia, também chamada de criometria, é um processo em que ocorre a diminuição da temperatura de congelamento de uma solução.
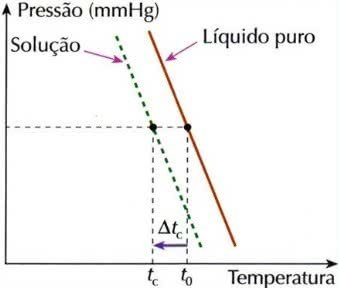
Gráfico do Efeito Criométrico
Isso porque quando se dissolve um soluto não-volátil em um líquido, a temperatura de congelação do líquido diminui.
Um exemplo de crioscopia são os aditivos anticongelantes que se colocam nos radiadores dos automóveis em locais onde a temperatura é muito baixa. Esse processo evita o congelamento da água, auxiliando na vida útil dos motores dos carros.
Além disso, o sal espalhado nas ruas dos locais onde o inverno é muito rigoroso, evita o acúmulo de gelo nas estradas.
Para calcular esse efeito coligativo, utiliza-se a seguinte fórmula:
Δtc = t0 – tc
Onde,
Δtc: abaixamento da temperatura de congelação da solução
t0: temperatura de congelação do solvente puro
tc: temperatura inicial de congelação do solvente na solução
Confira um experimento sobre essa propriedade em: Experimentos de Química
Lei de Raoult
A chamada “Lei de Raoult” foi proposta pelo químico francês François-Marie Raoult (1830-1901).
Ele estudou os efeitos coligativos (tonométrico, ebuliométrico e criométrico), auxiliando nos estudos das massas moleculares das substâncias químicas.
Ao estudar os fenômenos associados à fusão e ebulição da água, ele chegou à conclusão de que: ao dissolver 1 mol de qualquer soluto não-volátil e não-iônico em 1kg de solvente, tem-se sempre o mesmo efeito tonométrico, ebuliométrico ou criométrico.
Assim, a Lei de Raoult pode ser expressa da seguinte maneira:
“Numa solução de soluto não-volátil e não-iônico, o efeito coligativo é proporcional à molalidade da solução”.
Ela pode ser expressa da seguinte maneira:
Psolução = xsolvente . Psolvente puro
Leia também sobre o Número de Mol e a Massa Molar.
Osmometria
A osmometria é um tipo de propriedade coligativa que está relacionada com a pressão osmótica das soluções.
Lembre-se que osmose é um processo físico-químico que envolve a passagem de água de um meio menos concentrado (hipotônico) para outro mais concentrado (hipertônico).
Isso ocorre através de uma membrana semipermeável, a qual permite somente a passagem de água.
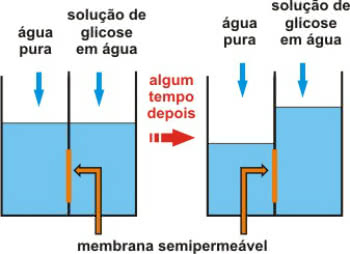
Ação da membrana semipermeável após um tempo
A chamada pressão osmótica é a pressão que permite que a água se movimente. Em outras palavras é a pressão exercida sobre a solução, a qual impede sua diluição pela passagem do solvente puro através da membrana semipermeável.
Sendo assim, a osmometria é o estudo e a medição da pressão osmótica nas soluções.
Note que na técnica de dessalinização da água (retirada de sal) é utilizado o processo chamado de osmose reversa.
Leia mais sobre Osmose.
Leis da Osmometria
O físico e químico holandês Jacobus Henricus Van’t Hoff (1852-1911) foi responsável por postular duas leis associadas à osmometria.
A primeira lei pode ser expressa da seguinte maneira:
“Em temperatura constante, a pressão osmótica é diretamente proporcional à molaridade da solução”
Já na segunda lei postulada por ele, temos o seguinte enunciado:
“Em molaridade constante, a pressão osmótica é diretamente proporcional à temperatura absoluta da solução”
Sendo assim, para calcular a pressão osmótica das soluções moleculares e diluídas, utiliza-se a fórmula:
π = MRT
sendo,
π: pressão osmótica da solução (atm)
M: molaridade da solução (mol/L)
R: constante universal dos gases perfeitos = 0,082 atm.L/mol.K
T: temperatura absoluta da solução (K)
Leia também Molaridade.
Exercícios de Vestibular com Gabarito
1. Comparando duas panelas, simultaneamente sobre dois queimadores iguais de um mesmo fogão, observa-se que a pressão dos gases sobre a água fervente na panela de pressão fechada é maior que aquela sobre a água fervente numa panela aberta.
Nessa situação, e se elas contêm exatamente as mesmas quantidades de todos os ingredientes, podemos afirmar que, comparando com o que ocorre na panela aberta, o tempo de cozimento na panela de pressão fechada será:
a) menor, pois a temperatura de ebulição será menor.
b) menor, pois a temperatura de ebulição será maior.
c) menor, pois a temperatura de ebulição não varia com a pressão.
d) igual, pois a temperatura de ebulição independe da pressão.
e) maior, pois a pressão será maior.
2. (UFRN) Em locais de inverno rigoroso, costuma-se adicionar uma certa quantidade de etilenoglicol na água dos radiadores de automóveis. O uso de uma solução, em vez de água, como líquido de refrigeração, deve-se ao fato de a solução apresentar:
a) menor calor de fusão.
b) menor ponto de congelamento.
c) maior ponto de congelamento.
d) maior calor de fusão.
3. (Vunesp) Uma das formas de conseguir cicatrizar feridas, segundo a crença popular, é a colocação de açúcar ou pó de café sobre elas. A propriedade coligativa que melhor explica a retirada de líquido, pelo procedimento descrito, favorecendo a cicatrização, é estudada pela:
a) osmometria.
b) crioscopia.
c) endoscopia.
d) tonoscopia.
e) ebuliometria.
4. (UFMG) Num congelador, há cinco formas que contêm líquidos diferentes, para fazer gelo e picolés de limão. Se as formas forem colocadas, ao mesmo tempo, no congelador e estiverem, inicialmente, com a mesma temperatura, vai congelar-se primeiro a forma que contém 500 ml de:
a) água pura.
b) solução, em água, contendo 50 ml de suco de limão.
c) solução, em água, contendo 100 ml de suco de limão.
d) solução, em água, contendo 50 ml de suco de limão e 50g de açúcar.
e) solução, em água, contendo 100 ml de suco de limão e 50g de açúcar.
5. (Cesgranrio-RJ) Determinou-se o ponto de fusão de uma substância x, encontrando-se um valor menor que o tabelado para essa substância. Isso pode significar que:
a) a quantidade de substância utilizada na determinação foi menor que o necessário.
b) a quantidade de substância utilizada na determinação foi maior que o necessário.
c) uma parte da substância não fundiu.
d) a substância contém impurezas.
e) a substância está 100% pura.
Propriedades Coligativas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/propriedades-coligativas/. Acesso em:

