Reações Endotérmicas e Exotérmicas
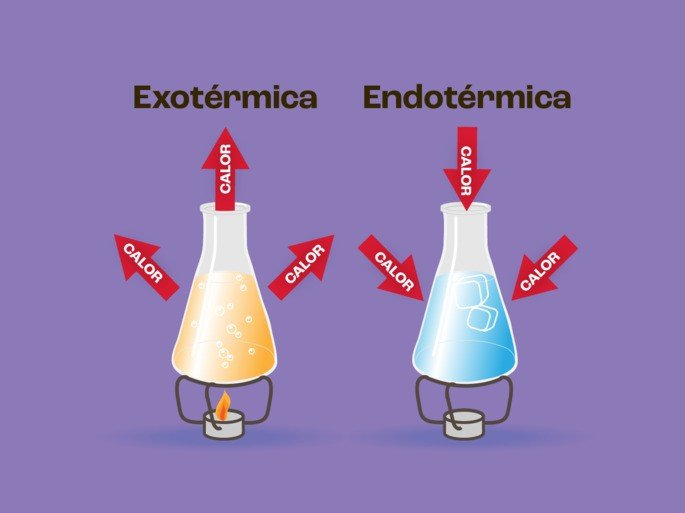
Reações endotérmicas são àquelas nas quais a energia é absorvida do ambiente, levando ao aumento da entalpia do sistema.
Por outro lado, nas reações exotérmicas a energia é liberada como forma de calor para o ambiente, levando à diminuição da entalpia do sistema.
Entalpia é a medida de energia de um sistema termodinâmico. Tais processos são estudados pela termoquímica.
Qual a diferença entre elas?
Reação Endotérmica é aquela em que há absorção de energia. Nesse processo, a energia é produzida e, de forma independente, é mantida.
As aves e os mamíferos têm a capacidade de manter a estabilidade da temperatura do corpo. Por esse motivo eles são chamados de animais endotérmicos, popularmente, “animais de sangue quente”.
Reação Exotérmica é aquela em que há liberação de energia. Nesse processo, a produção de energia somente persiste mediante o fornecimento contínuo de calor.
A mudança de estados físicos, nessa ordem: gasoso, líquido e sólido, é um exemplo de processo exotérmico. Cada um deles ocorre enquanto a energia é liberada, ou seja, há a liberação de calor.
Repare que ao invertemos essa ordem (sólido, líquido e gasoso), existe a captação de energia do ambiente em forma de calor. Neste caso, o processo é endotérmico.
Exemplos do Cotidiano
A gordura corporal funciona como um combustível no nosso corpo. Aquela que não é queimada, é absorvida por ele. Como se trata de um processo de absorção, é um exemplo de reação endotérmica.
Ao colocar uma panela no fogo para preparar um alimento estamos, por sua vez, diante de um processo exotérmico. Isso porque o calor que é liberado transformará esse alimento para que ele seja consumido.

E o que é Entalpia?
Entalpia é a energia existente em todas as substâncias, e são alteradas em decorrência das reações endotérmicas e exotérmicas.
Como não é possível calcular a entalpia, foi estabelecido o cálculo da sua variação.
Assim, mediante a comparação da entalpia padrão (temperatura de 25º C sob a pressão atmosférica de 1 atm), seria possível calcular a variação da entalpia.
Conforme a Lei de Hess, a entalpia final menos a entalpia inicial (ΔH = Hf – Hi) resulta nesse dado.
Se a reação endotérmica absorve energia, isso quer dizer que a entalpia do reagente é menor do que do produto. Logo, a variação da entalpia é positiva (ΔH > 0).
Por sua vez, se a reação exotérmica libera energia, isso quer dizer que a entalpia (energia) do reagente é maior do que a do produto. Logo, a variação da entalpia é negativa (ΔH < 0).
Leia também:
CASTILHO, Rubens. Reações Endotérmicas e Exotérmicas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/reacoes-endotermicas-e-exotermicas/. Acesso em:


