Termoquímica: o que é, reações químicas e entalpia
Termoquímica é a parte da química que estuda a quantidade de calor (energia) envolvida nas reações químicas.
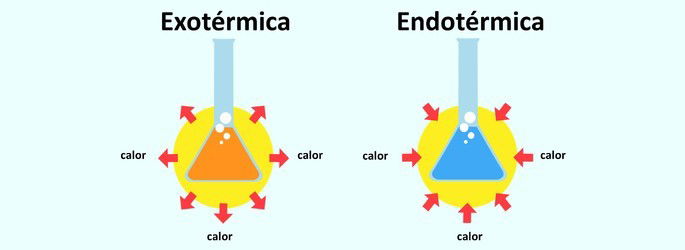
Quando uma reação libera calor, ela é classificada como exotérmica. A absorção de calor em uma reação, faz com que ela seja endotérmica.
A termoquímica estuda também a transferência de energia em alguns fenômenos físicos, tais como as mudanças de estados da matéria.
Termoquímica e calor
Nas reações químicas pode haver absorção ou liberação de energia. Essa transferência de calor é feita a partir do corpo que tem a temperatura mais alta para aquele que possui a temperatura mais baixa.
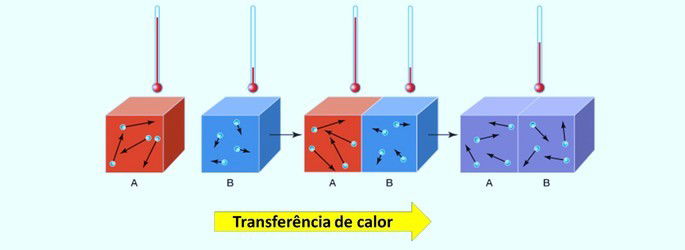
Vale lembrar que o calor, também chamado de energia calorífica, é um conceito que determina a troca de energia térmica entre dois corpos. O equilíbrio térmico é estabelecido quando os dois materiais atingem a mesma temperatura.
Reações Endotérmicas e Exotérmicas
Chama-se reação endotérmica a reação em que há absorção de calor. Dessa forma, um corpo absorve calor do meio em que ele está inserido. É por isso que a reação endotérmica provoca uma sensação de resfriamento.
Exemplo: Ao passar álcool no braço, o braço absorve o calor dessa substância. Mas, ao soprar para o braço depois de ter passado álcool, sentimos um friozinho, sensação que é resultado da reação endotérmica.
Já a reação exotérmica é o inverso. Trata-se da liberação de calor e, assim, a sensação é de aquecimento.
Exemplo: Num acampamento, as pessoas se colocam junto de uma fogueira para que o calor liberado pelas chamas aqueça quem está à volta.
As trocas térmicas também acontecem nas mudanças de estado físico. Ocorre que, na mudança do estado sólido para o líquido e do líquido para o gasoso, o processo é endotérmico. De maneira oposta, é exotérmica a mudança do estado gasoso para o líquido e do líquido para o sólido.
Entalpia
Entalpia (H) é a energia trocada nas reações de absorção e de liberação de energia, respectivamente, endotérmica e exotérmica.
Não existe um aparelho que seja capaz de medir a entalpia. Por esse motivo, mede-se a sua variação (ΔH), o que é feito considerando a entalpia do reagente (energia inicial) e a entalpia do produto (energia final).
Os tipos de entalpia mais recorrentes são:
| Entalpia de Formação | Energia absorvida ou liberada necessária para formar 1 mol de uma substância. |
|---|---|
| Entalpia de Combustão | Energia liberada que resulta na queima de 1 mol de substância. |
| Entalpia de Ligação | Energia absorvida na quebra de 1 mol de ligação química, no estado gasoso. |
Enquanto a entalpia mede a energia, a entropia mede o grau de desordem das reações químicas.
Lei de Hess
Germain Henry Hess estabeleceu que:
A variação de entalpia (ΔH) em uma reação química depende apenas dos estados inicial e final da reação, independente do número de reações.
A variação da energia, de acordo com a Lei de Hess, é estabelecida através da seguinte fórmula:
ΔH = Hf – Hi
Onde,
- ΔH: variação da entalpia
- Hf: entalpia final ou entalpia do produto
- Hi: entalpia inicial ou entalpia do reagente
A partir disso, concluímos que a variação da entalpia é negativa quando estamos diante de uma reação exotérmica. Por sua vez, a variação da entalpia é positiva quando estamos diante de uma reação endotérmica.
Não deixe de conferir esses textos para aprender ainda mais sobre o tema:
Exercícios com gabarito comentado
1. (Udesc/2011) Dadas as seguintes equações:
| (A) | 2CO(g) + O2(g) → 2CO2(g) | ΔH = - 565,6 kj |
| (B) | 2CH4O(g) + 3O2(g) → 2CO2(g) + 4H2O(l) | ΔH = - 1462,6 kj |
| (C) | 3O2(g) → 2O3(g) | ΔH = + 426,9 kj |
| (D) | Fe2O3(g) + 3C(s) → 2Fe(s) + 3CO(g) | ΔH = + 490,8 kj |
Considere as seguintes proposições em relação às equações:
I. As reações (A) e (B) são endotérmicas.
II. As reações (A) e (B) são exotérmicas.
III. As reações (C) e (D) são exotérmicas.
IV. As reações (C) e (D) são endotérmicas.
V. A reação com maior liberação de energia é a (B).
VI. A reação com maior liberação de energia é a (D).
Assinale a alternativa correta.
a) Somente as afirmativas II, III e V são verdadeiras.
b) Somente as afirmativas I, III e VI são verdadeiras.
c) Somente as afirmativas I, IV e VI são verdadeiras.
d) Somente as afirmativas II, V e VI são verdadeiras.
e) Somente as afirmativas II, IV e V são verdadeiras.
Esses textos te ajudarão a aumentar seu conhecimento:
2. (Enem/2011) Uma opção não usual, para o cozimento do feijão, é o uso de uma garrafa térmica. Em uma panela, coloca-se uma parte de feijão e três partes de água e deixa-se ferver o conjunto por cerca de 5 minutos, logo após transfere-se todo o material para uma garrafa térmica. Aproximadamente 8 horas depois, o feijão estará cozido.
O cozimento do feijão ocorre dentro da garrafa térmica, pois
a) a água reage com o feijão, e essa reação é exotérmica.
b) o feijão continua absorvendo calor da água que o envolve, por ser um processo endotérmico.
c) o sistema considerado é praticamente isolado, não permitindo que o feijão ganhe ou perca energia.
d) a garrafa térmica fornece energia suficiente para o cozimento do feijão, uma vez iniciada a reação.
e) a energia envolvida na reação aquece a água, que mantém constante a temperatura, por ser um processo exotérmico.
Saiba mais:
- Transformações físicas e químicas;
- Calor e temperatura;
- Energia térmica;
- Exercícios sobre Cinética Química.
BATISTA, Carolina. Termoquímica: o que é, reações químicas e entalpia. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/termoquimica/. Acesso em:


