Titulação
Titulação é uma técnica utilizada para determinar a quantidade de matéria em uma amostra utilizando uma solução de concentração conhecida.
Em outras palavras, titulação é uma análise química quantitativa. Nesse processo, a amostra tem sua concentração determinada por meio de uma reação química ao ser misturada com outra substância.
Essa técnica também é chamada de volumetria ou titulometria. O tipo mais conhecido é a titulação ácido-base ou neutralização. O uso de indicadores de pH nesse processo é útil para determinar o ponto final da titulação, indicando que toda a amostra reagiu.
A titulação serve para determinar de maneira precisa a quantidade de uma substância, confirmar se a concentração descrita no rótulo é verdadeira ou se a quantidade de um composto químico é a indicada na embalagem.
Processo de Titulação
| Etapa | Ilustração | Descrição |
|---|---|---|
| Pesagem da amostra |  |
Com a amostra sólida em um vidro de relógio, é feita a pesagem na balança. |
| Dissolução da amostra |  |
A amostra é transferida para um erlenmeyer com água, onde é feita a dissolução. |
| Solução-problema | 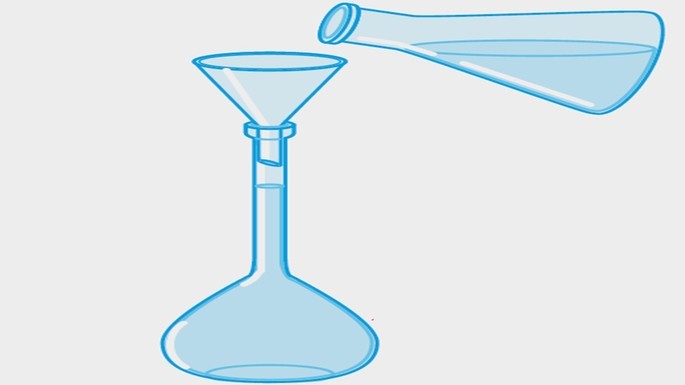 |
A solução é transferida para um balão volumétrico e o volume é completado com água, criando-se a solução-problema. |
| Transferência de alíquota | 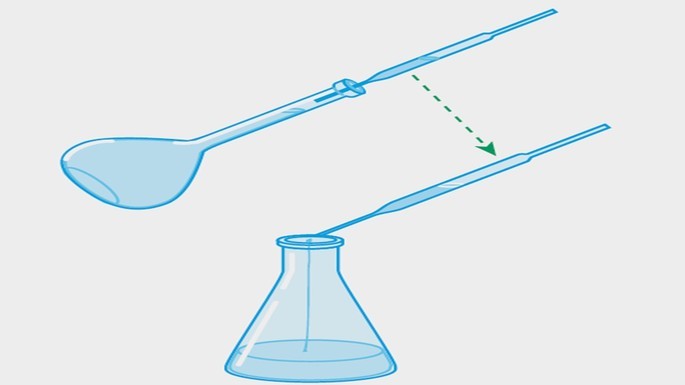 |
Retirada de uma alíquota da solução problema com o auxílio de uma pipeta e transferida para um erlenmeyer. |
| Titulação | 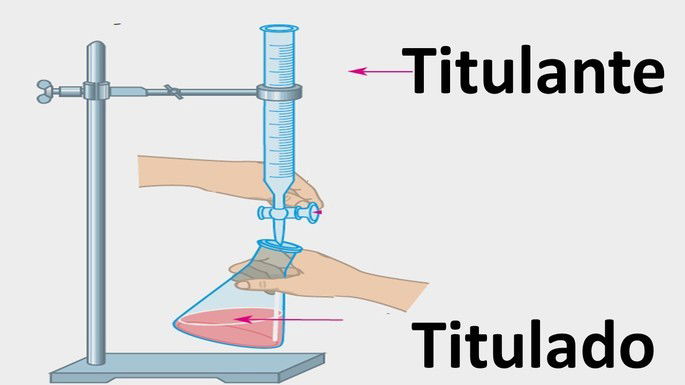 |
Ao erlenmeyer, é adicionado à solução problema (titulado) e na bureta é inserida a solução de concentração conhecida (titulante). |
Ao titulado também é adicionado um indicador ácido-base para indicar o momento que se deve parar a titulação pela mudança de coloração. A mudança de cor indica o ponto final ou ponto de viragem da titulação.
Depois isso, ao persistir a mudança de coloração, verifica-se o volume de titulante utilizado e os cálculos estequiométricos nos ajudarão a descobrir a concentração da solução titulada.
Titulação ácido-base
Para esse tipo de análise volumétrica, sendo utilizado um ácido forte e uma base forte, a reação química entre os componentes ocorre da seguinte forma:
HX + YOH → YX + H2O
Por exemplo, podemos utilizar uma solução hidróxido de sódio (NaOH) para descobrir a concentração de uma solução de ácido clorídrico (HCl) por meio da titulação.
Quando as duas substâncias químicas entram em contato, ocorre a reação de neutralização:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Para encontrar a concentração da solução de HCl, temos que lembrar de:
- Anotar a concentração da solução de NaOH utilizada
- Anotar o volume de HCl utilizado na titulação
- Estar atento ao momento que a solução mudar de cor e encerrar a titulação
- Anotar o volume de NaOH utilizado para reagir com todo HCl
O ponto de equivalência é atingido quando:
nº de mol de H+ = nº de mol de OH–
Se utilizarmos como indicador a fenolftaleína, a solução antes da titulação estará incolor, indicando pH ácido. No final da titulação, a cor da solução deve estar levemente rosa, pois indica que todo ácido reagiu com a base adicionada.
Veja também: Conceito e determinação de pH e pOH
Cálculos de Titulação
Após realizada a titulação, são feitos cálculos para determinar a quantidade de substância contida na amostra.
Veja a seguir como ocorre a titulação ácido-base:
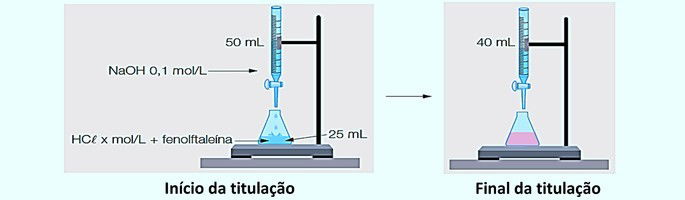
Observando as imagens, podemos fazer as seguintes considerações:
| Início da titulação | Final da titulação |
|---|---|
|
|
A partir desses dados, efetuamos os cálculos da seguinte forma:
1º passo: Calcular o volume gasto na titulação.
Transformando a unidade do volume para litros, obtemos o resultado:
2º passo: Calcular o número de mols de NaOH utilizados na titulação.
Como a molaridade da solução é de 0,1 mol/L, temos:
3º passo: Interpretar a estequiometria da reação.
Pela estequiometria, para a reação ocorrer 1 mol de base deve reagir com 1 mol de ácido. Sendo assim, como foi utilizado 0,001 mol de NaOH, essa quantidade reagiu com 0,001 mol de HCl.
4º passo: Calcular a concentração molar do ácido clorídrico (HCl).
Como o volume de ácido utilizado está em mL, devemos transformá-lo em L:
Sabendo que o volume utilizado foi de 0,025 L e a quantidade de ácido que reagiu foi de 0,001 mol, calculamos a molaridade da seguinte forma:
Outra maneira de encontrar a concentração de interesse, é utilizando a fórmula de titulação:
O número de mols corresponde à multiplicação da concentração molar pelo volume da solução.
Veja também: Estequiometria
Tipos de titulação
Os principais tipos de titulação realizados em um laboratório químico são:
| Tipo | Descrição |
|---|---|
| Ácido-base |
Também conhecida como acidimetria-alcalimetria, ocorre uma reação ácido-base que é perceptível pelo uso de um indicador de pH. Exemplo de reação: H+ + OH- → H2O |
| Precipitação |
A reação entre o titulante e o titulado resulta na formação de um precipitado. Exemplo de reação: Ag+ + Cl- ⇔ AgCl(s) |
| Oxidação-redução |
As espécies envolvidas na titulação reagem por meio da transferência de elétrons, onde uma irá oxidar e a outra reduzir. Exemplo de reação: Fe2+ + Ce4+ ⇔ Fe3+ + Ce3+ |
| Complexação |
Formam-se complexos solúveis e o titulante mais utilizado nesse tipo de análise é o EDTA (Sal dissódico do ácido etilenodiaminotetracético) para determinar metais. Exemplo de reação: Y4- + Ca2+ ⇔ CaY2- |
Como fazer uma titulação?
Assista ao vídeo a seguir e veja como realizar uma titulação.
BATISTA, Carolina. Titulação. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/titulacao/. Acesso em:


