Diagrama de Pauling
O Diagrama de Pauling, também conhecido como Diagrama de Energia, é a representação da distribuição eletrônica através de subníveis de energia.
Através do esquema, o químico Linus Carl Pauling (1901-1994) sugeriu algo além do que já havia com relação à distribuição de elétrons dos átomos de elementos químicos.
Para melhorar a disposição, Pauling propôs os subníveis de energia. Através deles, seria possível dispor os elétrons do menor ao maior nível de energia de um átomo no seu estado fundamental.
Distribuição eletrônica de Linus Pauling
De acordo com o modelo proposto por Pauling, a eletrosfera está dividida em 7 camadas eletrônicas (K, L, M, N, O, P e Q) ao redor do núcleo atômico, sendo que cada uma delas permite um número máximo de elétrons, que são 2, 8, 18, 32, 32,18 e 8, respectivamente.
Na distribuição de eletrônica também foram atribuídos os subníveis de energia, apresentando primeiro o elétron de menor energia até chegar ao elétron de energia maior.
| Camadas Eletrônicas | N.º Máximo de Elétrons | Subníveis de Energia | ||||
|---|---|---|---|---|---|---|
| 1 | K | 2 e- | 1s2 | |||
| 2 | L | 8 e- | 2s2 | 2p6 | ||
| 3 | M | 18 e- | 3s2 | 3p6 | 3d10 | |
| 4 | N | 32 e- | 4s2 | 4p6 | 4d10 | 4f14 |
| 5 | O | 32 e- | 5s2 | 5p6 | 5d10 | 5f14 |
| 6 | P | 18 e- | 6s2 | 6p6 | 6d10 | |
| 7 | Q | 8 e- | 7s2 | 7p6 | ||
A camada K tem apenas um subnível (s), a camada L tem dois subníveis (s e p), a camada m tem três subníveis (s, p e d) e, assim, respectivamente.
Os subníveis s permitem até 2 elétrons, enquanto os subníveis p permitem até 6 elétrons. Na sequência, os subníveis d permitem até 10 elétrons, enquanto os subníveis f permitem até 14 elétrons.
Repare que a soma dos elétrons comportados em cada subnível por camada eletrônica resulta no número máximo de elétrons em cada uma das 7 camadas.
K: s2 = 2
L e Q: s2 + p6 = 8
M e P: s2 + p6 + d10 = 18
N e O: s2 + p6 + d10 + f14= 32
Foi, então, que Pauling descobriu a ordem crescente de energia:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
A partir daí surgem as setas diagonais no esquema para fazer a distribuição eletrônica dos elementos:
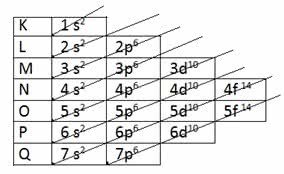 Diagrama de Pauling
Diagrama de Pauling
Exemplo da distribuição eletrônica do fósforo 15P:
1s2 2s2 2p6 3s2 3p3
Como até 3s2 já tínhamos um total de 12 elétrons (2 + 2 + 6 + 2), precisamos apenas de mais 3 elétrons do subnível 3p6.
Assim, podemos ir buscar a quantidade necessária de elétrons, desde que ela não seja superior a 6, que é o número máximo que o subnível 3p6 comporta.
Leia também Camada de Valência e Números Quânticos.
Exercícios resolvidos sobre distribuição eletrônica
Questão 1
(Unirio) “Os implantes dentários estão mais seguros no Brasil e já atendem às normas internacionais de qualidade. O grande salto de qualidade aconteceu no processo de confecção dos parafusos e pinos de titânio, que compõem as próteses. Feitas com ligas de titânio, essas próteses são usadas para fixar coroas dentárias, aparelhos ortodônticos e dentaduras, nos ossos da mandíbula e do maxilar.” (Jornal do Brasil, outubro 1996.)
Considerando que o número atômico do titânio é 22, sua configuração eletrônica será:
a) 1s2 2s2 2p6 3s2 3p3
b) 1s2 2s2 2p6 3s2 3p5
c) 1s2 2s2 2p6 3s2 3p6 4s2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Questão 2
(ACAFE) Considerando-se um elemento M genérico qualquer, que apresenta configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d5, pode-se afirmar que:
I. seu número atômico é 25;
II. possui 7 elétrons na última camada;
III. apresenta 5 elétrons desemparelhados;
IV. pertencem a família 7A.
Estão corretas as afirmações:
a) I, II e III somente
b) I e III somente
c) II e IV somente
d) I e IV somente
e) II, III e IV somente
Questão 3
(UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
Teste ainda mais os seus conhecimentos! Resolva também:
BATISTA, Carolina. Diagrama de Pauling. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/diagrama-de-pauling/. Acesso em:


