Monóxido de Carbono
O monóxido de carbono é um gás incolor, sem cheiro, inflamável e tóxico.
Sua fórmula molecular é CO. É constituído por uma molécula de carbono e oxigênio.
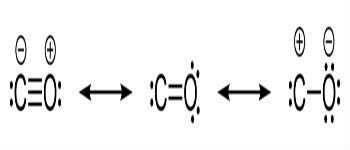
Fórmulas estruturais do monóxido de carbono e ligações químicas entre o carbono e oxigênio
Ele é originado através de duas formas:
- Fontes emissoras naturais: atividade de vulcões, gás natural e descargas elétricas.
- Atividades humanas: resultado da combustão incompleta de combustíveis fósseis. As queimadas produzem toneladas de CO, sendo uma das principais atividades que liberam CO para a atmosfera.
Características
O monóxido de carbono pertence ao grupo dos óxidos. É classificado como óxido neutro, aqueles formados por um ametal mais oxigênio. Além disso, não reage com a água, ácidos e bases.
É usado como agente redutor, retira o oxigênio de um composto e produz o dióxido de carbono (CO2). Por isso, é muito comum o seu uso no processamento de minérios, como o ferro. Como também, na produção de substâncias orgânicas, como ácido acético, plásticos, metanol, entre outros.
Ao reagir com o oxigênio do ar, produz dióxido de carbono. Conforme a seguinte reação química: 2 CO + O2 → 2 CO2
Em águas superficiais, a elevada concentração de monóxido de carbono serve de fonte de energia para microrganismos.
O monóxido de carbono é um dos gases de efeito estufa. Sua concentração na atmosfera contribui para maior retenção de calor. É considerado, por isso, um gás poluente.
Intoxicação
O CO apresenta alta afinidade com a hemoglobina. Por ser tóxico, sua inalação ocasiona efeitos sobre a saúde humana e pode levar até a morte.
Pelo fato do CO não possuir cheiro, ele pode estar sendo inalado sem que seja percebido. Por isso, em alguns casos, a pessoa demora a perceber a intoxicação.
Quando inalado em baixa concentração causa enxaquecas, lentidão de raciocínio, irritação nos olhos e perda de habilidade manual. Em altas concentrações pode causar a convulsões, perda de consciência e até a morte por asfixia.
Mas como acontece a intoxicação?
A hemoglobina liga-se, naturalmente, ao O2 e o transporta aos tecidos do corpo. Porém, a afinidade entre o CO e a hemoglobina é muito maior, cerca de 250 vezes mais do que com o O2.
Na presença de CO, a hemoglobina liga-se a ele, impedindo o transporte de oxigênio para as células. A combinação do CO com a hemoglobina origina a carboxihemoglobina.
As principais causas de intoxicação com CO ocorrem nas seguintes situações:
- Motores de carro em funcionamento em ambientes fechados;
- Queima de gás natural em aquecedores ineficientes;
- Escape de gás de cozinha ou forno a lenha, em locais mal ventilados.
Em países de clima frio, as casas tendem a ficar mais tempo fechadas e com uso de sistemas de aquecimento. Para evitar acidentes com o gás, cada vez mais utiliza-se detectores de CO.
Saiba mais, leia também:
MAGALHÃES, Lana. Monóxido de Carbono. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/monoxido-de-carbono/. Acesso em:


