Soluções químicas
As soluções químicas são misturas homogêneas formadas por duas ou mais substâncias.
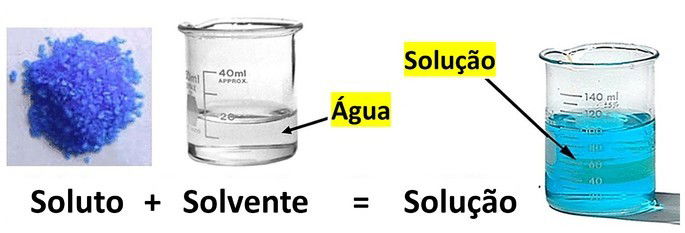
Os componentes de uma solução são denominados de soluto e solvente:
- Soluto: representa a substância dissolvida.
- Solvente: é a substância que dissolve.
Geralmente, o soluto de uma solução está presente em menor quantidade que o solvente.
Um exemplo de solução é a mistura de água e açúcar, tendo a água como solvente e o açúcar como soluto.
A água é considerada o solvente universal, devido ao fato de dissolver uma grande quantidade de substâncias.

Classificação das soluções
Como vimos, uma solução consiste de duas partes: o soluto e o solvente.
Porém, esses dois componentes podem apresentar diferentes quantidades e características. Como resultado, existem diversos tipos de soluções e cada uma delas baseia-se em uma determinada condição.
Quantidade de soluto
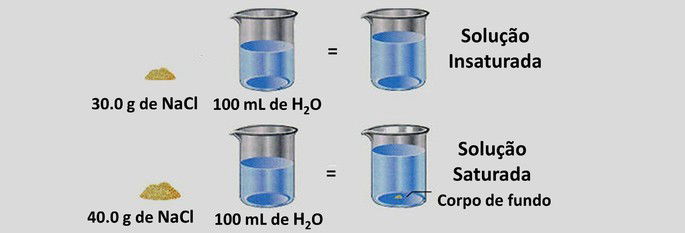
De acordo com a quantidade de soluto que possuem, as soluções químicas podem ser:
- Soluções saturadas: solução com a quantidade máxima de soluto totalmente dissolvido pelo solvente. Se mais soluto for acrescentado, o excesso acumula-se formando um corpo de fundo.
- Soluções insaturadas: também chamada de não saturada, esse tipo de solução contém menor quantidade de soluto.
- Soluções supersaturadas: são soluções instáveis, nas quais a quantidade de soluto excede a capacidade de solubilidade do solvente.
Estado físico
As soluções também podem ser classificadas de acordo com o seu estado físico:
- Soluções sólidas: formadas por solutos e solventes em estado sólido. Por exemplo, a união de cobre e níquel, que forma uma liga metálica.
- Soluções líquidas: formadas por solventes em estado líquido e solutos que podem estar em estado sólido, líquido ou gasoso. Por exemplo, o sal dissolvido em água.
- Soluções gasosas: formadas por solutos e solventes em estado gasoso. Por exemplo, o ar atmosférico.
Natureza do soluto
Além disso, segundo a natureza do soluto, as soluções químicas são classificadas em:
- Soluções moleculares: quando as partículas dispersas na solução são moléculas, por exemplo, o açúcar (molécula C12H22O11).
- Soluções iônicas: quando as partículas dispersas na solução são íons, por exemplo, o sal comum cloreto de sódio (NaCl), formado pelos íons Na+ e Cl-.
Para entender a diferença entre íons e moléculas, sugerimos esses textos:
Coeficiente de solubilidade
Solubilidade é a propriedade física das substâncias de se dissolverem, ou não, em um determinado solvente.
O coeficiente de solubilidade representa a capacidade máxima do soluto de se dissolver em uma determinada quantidade de solvente. Isso conforme as condições de temperatura e pressão.
Conforme a solubilidade, as soluções podem ser:
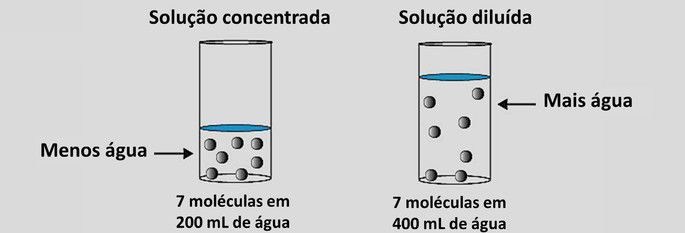
- Soluções diluídas: a quantidade de soluto é menor em relação ao solvente.
- Soluções concentradas: a quantidade de soluto é maior que a de solvente.
Quando temos uma solução concentrada, podemos notar que o soluto não se dissolve completamente no solvente, o que leva a presença de um corpo de fundo.
Para calcular o coeficiente de solubilidade é utilizada a seguinte fórmula:
Onde:
Cs: coeficiente de solubilidade
m1: massa do soluto
m2: massa do solvente
Concentração das soluções
O conceito de concentração (C) está intimamente relacionado com a quantidade de soluto e de solvente presente em uma solução química.
Sendo assim, a concentração da solução indica a quantidade, em gramas, de soluto existente em um litro de solução.
Para se calcular a concentração utiliza-se a seguinte fórmula:
Onde:
C: concentração
m: massa do soluto
V: volume da solução
No Sistema Internacional (SI), a concentração é dada em gramas por litro (g/L), a massa em gramas (g) e o volume em litros (L).
Fique Atento!
Não devemos confundir o conceito de concentração (C) com o de densidade (d) da solução:
| Concentração comum | Densidade |
|---|---|
Para testar seus conhecimentos sobre concentração e densidade, confira os textos abaixo:
Diluição das soluções
A diluição de soluções corresponde à adição mais solvente em uma solução.
Como resultado, passamos de uma solução mais concentrada para uma solução mais diluída.
É importante ressaltar que a mudança ocorre no volume da solução e não na massa do soluto.
Podemos concluir então que quando há o aumento do volume, a concentração diminui. Em outras palavras, o volume e a concentração de uma solução são inversamente proporcionais.
Para saber mais, recomendamos a leitura desses textos:
Exercícios sobre soluções químicas
1. (Mackenzie) Um exemplo típico de solução supersaturada é:
a) água mineral natural.
b) soro caseiro.
c) refrigerante em recipiente fechado.
d) álcool 46 °GL.
e) vinagre.
2. (UFMG) Para limpar um tecido sujo de graxa, recomenda-se usar:
a) gasolina.
b) vinagre.
c) etanol.
d) água.
Saiba mais sobre os assuntos relacionados com essa questão:
3. (UFRGS) Um determinado sal apresenta solubilidade em água igual a 135 g/L, a 25 °C. Dissolvendo-se, completamente, 150 g desse sal em um litro de água a 40 °C, e resfriando-se lentamente o sistema até 25 °C, obtém-se um sistema homogêneo cuja solução será:
a) diluída.
b) concentrada.
c) insaturada.
d) saturada.
e) supersaturada.
4. (UAM) Se dissolvermos totalmente uma certa quantidade de sal em solvente e por qualquer perturbação uma parte do sal se depositar, qual a solução que teremos no final?
a) saturada com corpo de fundo.
b) supersaturada com corpo de fundo.
c) insaturada.
d) supersaturada sem corpo de fundo.
e) saturada sem corpo de fundo.
5. (UNITAU) Na carbonatação de um refrigerante, as condições em que se deve dissolver o gás carbônico na bebida são:
a) pressão e temperatura quaisquer.
b) pressão e temperatura elevadas.
c) pressão e temperatura baixas.
d) baixa pressão elevada temperatura.
e) alta pressão e baixa temperatura.
Confira mais questões com resolução comentada em exercícios sobre soluções.
BATISTA, Carolina. Soluções químicas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/solucoes-quimicas/. Acesso em:


