Soluto e Solvente: o que são, diferenças e exemplos
Soluto e solvente são os dois componentes de uma mistura homogênea chamada de solução química.
- Soluto: é a substância que se encontra dispersa no solvente. Corresponde a substância que será dissolvida e, geralmente, apresenta-se em menor quantidade na solução.
- Solvente: é a substância na qual o soluto será dissolvido para formação de um novo produto. Apresenta-se em maior quantidade na solução.
A dissolução entre o soluto (disperso) e o solvente (dispersante) ocorre através de interações entre suas moléculas.
A diferença entre esses dois componentes de uma solução é que o soluto é a substância que será dissolvida e o solvente é a substância que irá realizar a dissolução.
O solvente mais conhecido é a água, considerada o solvente universal. Isso porque, ela possui a capacidade de dissolver uma grande quantidade de substâncias.
Exemplos de soluto e solvente
Veja alguns exemplos de soluções químicas e descubra os solutos e solventes de cada uma delas:
Água e sal
- Soluto: Sal de cozinha - Cloreto de sódio (NaCl)
- Solvente: Água
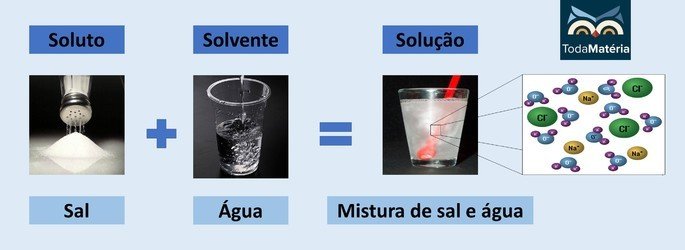
Por se tratar de um composto iônico, o cloreto de sódio na solução dissocia-se e forma íons que, por sua vez, são solvatados por moléculas de água.
O polo positivo da água (H+) interage com o ânion do sal (Cl-) e o polo negativo da água (O2-) interage com o cátion (Na+).
Esse é um tipo de solução eletrolítica, pois as espécies iônicas em solução são capazes de conduzir corrente elétrica.
Água e açúcar
- Soluto: Açúcar - Sacarose (C12H22O11)
- Solvente: Água
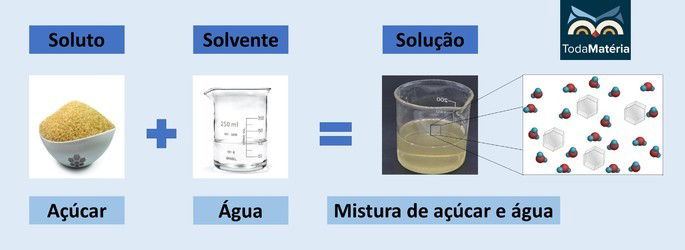
O açúcar é um composto covalente e quando dissolvido em água as moléculas se dispersam, mas não alteram a sua identidade.
Essa solução aquosa é classificada como não eletrolítica, pois o soluto disperso em solução é neutro e, por isso, não reage com a água.
Vinagre
- Soluto: Ácido acético (CH3COOH)
- Solvente: Água
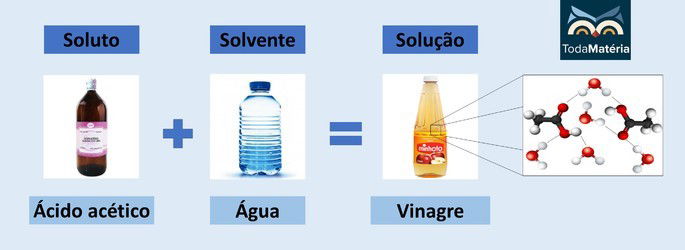
O vinagre é uma solução que contém pelo menos 4% de ácido acético, um ácido carboxílico que, por ser polar, interage com a água, também polar, por meio das ligações de hidrogênio.
Uma importante regra para solubilidade é que semelhante dissolve semelhante. Compostos polares são dissolvidos em solventes polares, enquanto que substâncias apolares dissolvem-se em solventes apolares.
Outras soluções
Além das soluções líquidas, existem também as soluções gasosas e sólidas.
O ar que respiramos é um exemplo de solução gasosa, cujos gases em maior quantidade são nitrogênio (78%) e oxigênio (21%).
As ligas metálicas são soluções sólidas. Por exemplo, o latão (zinco e cobre) é uma mistura utilizada para fabricar instrumentos musicais.
Quer adquirir mais conhecimento? Então leia esses outros textos:
O que é o Coeficiente de Solubilidade?
O coeficiente de solubilidade é o limite de soluto adicionado ao solvente a uma determinada temperatura, para formar uma solução saturada.
O coeficiente de solubilidade varia de acordo com as condições, podendo aumentar ou diminuir conforme as mudanças de temperatura e do soluto em questão.
Existe um limite para que o solvente possa realizar a dissolução.
Exemplo: Se você colocar açúcar em um copo com água, no primeiro momento, perceberá que o açúcar desaparece na água.
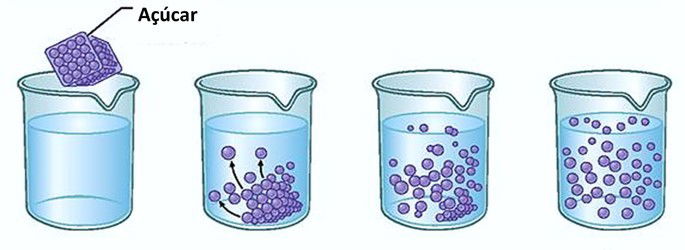
Entretanto, se continuar a acrescentar açúcar, perceberá que em determinado momento ele começará a se acumular no fundo do copo.
Isso acontece porque a água, que é o solvente, atingiu o seu limite de solubilidade e a quantidade máxima de concentração. O soluto que resta no fundo do recipiente e que não se dissolve é chamado de corpo de fundo.
O excesso de açúcar no fundo do copo não será dissolvido e não influenciará na concentração da solução. Além disso, o açúcar depositado no fundo do copo não deixará a água mais doce.
Classificação das soluções
As soluções podem ser classificadas quanto à quantidade de soluto dissolvido. Assim, podem ser de três tipos: saturadas, insaturadas e supersaturadas.
- Solução saturada: A solução atingiu o limite do coeficiente de solubilidade, ou seja, há uma quantidade máxima de soluto dissolvido no solvente, em uma determinada temperatura.
- Solução insaturada: A quantidade de soluto dissolvido ainda não atingiu o coeficiente de solubilidade. Isso significa que pode ser acrescentado mais soluto.
- Solução supersaturada: Há mais soluto dissolvido do que em condições normais. Nesse caso, apresentam precipitado.
Para saber mais sobre soluções, leia os textos a seguir:
Concentração de soluções
A partir do soluto e solvente é possível calcular a concentração de uma solução.
A concentração comum é definida como a relação da massa do soluto dissolvido em um certo volume de solução.
O cálculo da concentração é feito através da seguinte fórmula:
Sendo,
C: Concentração (g/L);
m: massa do soluto (g);
V: volume da solução (L).
Exemplo:
(Faap) Calcule a concentração, em g/L, de uma solução aquosa de nitrato de sódio que contém 30 g de sal em 400 mL de solução:
Resolução:
Observe as informações relacionadas com as quantidades de soluto e solvente. Existem 30 g de sal (soluto) em 400 mL de solução aquosa (solvente).
Porém, o volume está em mL e precisamos transformá-lo para L:
Agora, para saber a concentração, deve-se apenas aplicar a fórmula:
Com esse resultado, chegamos a conclusão que ao misturarmos 30 g de sal com 400 mL de água obteremos uma solução com concentração de 75 g/L.
Para mais informações sobre como calcular a concentração comum, esses textos serão úteis:
BATISTA, Carolina. Soluto e Solvente: o que são, diferenças e exemplos. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/soluto-e-solvente/. Acesso em:


