Alotropia: o que é e os diferentes exemplos (com exercícios)
Alotropia é quando um mesmo elemento químico pode formar diferentes substâncias simples. Um exemplo é o carbono, que pode formar o grafite e o diamante. Outro exemplo é o oxigênio, que pode formar o ozônio.
Isso acontece de duas maneiras: ou muda a quantidade de átomos na molécula (como O₂ e O₃), ou muda o jeito como os átomos estão organizados (como no grafite e no diamante).
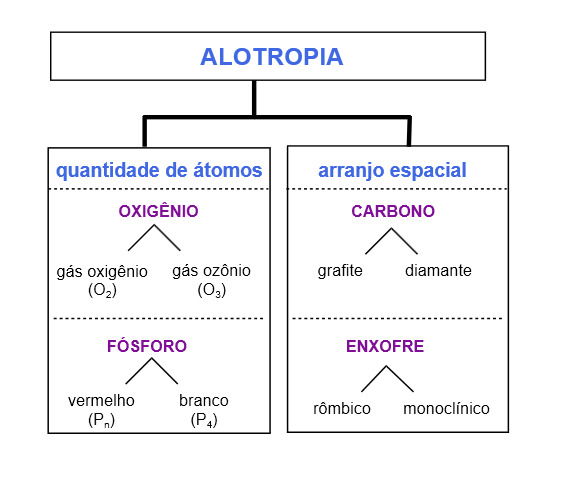
Alotropia do carbono
Os alótropos de carbono mais comuns são o grafite e o diamante, mas há outros alótropos de carbono. São exemplos fulereno, nanotubo de carbono e diamante lonsdaleíta.
A alotropia do carbono decorre da organização atômica, ou seja, a forma como os átomos se dispõem geometricamente.
Os átomos de grafite são unidos de três em três e apresentam a forma de hexágono.
Uma camada de grafite corresponde ao nanomaterial grafeno.
Os átomos de diamante, por sua vez, são atraídos de quatro em quatro e apresentam a forma de octaedro.
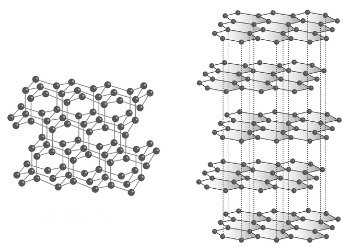
Alotropia do enxofre
O enxofre possui várias formas alotrópicas (S2, S4, S6). Dentre as mesmas se destacam o enxofre ortorrômbico, ou rômbico, e o enxofre monoclínico, ambas representadas por S8, mas agrupadas de formas diferentes.
A alotropia do enxofre decorre da organização atômica, ou seja, a forma como os átomos se dispõem geometricamente.
Alotropia do oxigênio
O oxigênio forma dois alótropos: o gás oxigênio (O2) e o gás ozônio (O3).
Pelo fato de ser formado de átomos de oxigênio em número de dois a dois, formam moléculas biatômicas. Quanto aos átomos de ozônio, eles se unem de três em três, formando moléculas triatômicas.

A alotropia do oxigênio acontece em função do número de átomos presentes nas moléculas, o que é chamado de alotropia por atomicidade.
Alotropia do fósforo
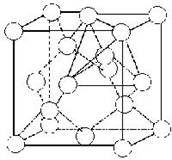
As formas de alotropia do fósforo mais conhecidas são o fósforo vermelho e o fósforo branco.
Enquanto o fósforo vermelho não tem uma estrutura definida (Pn), o fósforo branco é formado pela estrutura tetraédrica, ou seja, por quatro átomos de fósforo (P4).
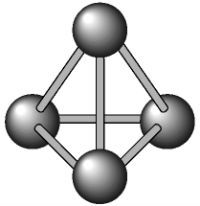
A alotropia do fósforo, tal como a do oxigênio, é feita por atomicidade, o que significa que ela depende do número de átomos presentes nas moléculas.
Exercício
Questão 1
O que caracteriza a alotropia em um elemento químico?
a) A capacidade de formar compostos iônicos diferentes.
b) A capacidade de formar substâncias simples diferentes, seja mudando o número de átomos por molécula ou a disposição estrutural.
c) A capacidade de reagir com diversos outros elementos de forma espontânea.
d) A capacidade de ser solúvel em diferentes solventes.
A alotropia ocorre quando um mesmo elemento forma mais de uma substância simples. Isso pode acontecer pela variação na quantidade de átomos por molécula (como o oxigênio, que forma O₂ e O₃) ou pela diferença no arranjo dos átomos na estrutura (como o carbono, que forma grafite e diamante).
Questão 2
Qual das seguintes opções apresenta um exemplo de substâncias alótropas?
a) Gás carbônico (CO₂) e monóxido de carbono (CO).
b). Água (H₂O) e água pesada (D₂O).
c) Oxigênio (O₂) e ozônio (O₃).
d) Grafite (C) e cloreto de sódio (NaCl).
Oxigênio (O₂) e ozônio (O₃) são exemplos de variação no número de átomos por molécula para um mesmo elemento químico. As outras alternativas incluem substâncias diferentes formadas por mais de um elemento químico ou compostos que não se encaixam no conceito de alotropia.
Para praticar mais: Exercício sobre alotropia (com questões resolvidas)
Leia também Carbono e Substâncias puras e misturas.
Referências Bibliográficas
FELTRE, Ricardo. Fundamentos de Química: vol. único. 4ª.ed. São Paulo: Moderna, 2005. 700 p.
PERUZZO. F.M.; CANTO. E.L., Química na abordagem do cotidiano, volume 1, 4ª edição, ed moderna, São Paulo, 2006.
VIEIRA, Natália. Alotropia: o que é e os diferentes exemplos (com exercícios). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/alotropia/. Acesso em:


