Camada de Valência
A Camada de Valência é a última camada eletrônica de um átomo. Por ser a camada mais externa, também é a que fica mais distante do núcleo atômico.
De acordo com a Regra do Octeto, a camada de valência precisa de oito elétrons para se estabilizar.
Assim, os átomos adquirem estabilidade quando têm 8 elétrons na camada de valência. Isso acontece com os gases nobres, eles apresentam a camada de valência completa. A única exceção é o elemento Hélio que possui 2 elétrons.
Os demais elementos precisam fazer ligações químicas para receber os elétrons faltantes e alcançar os oito elétrons na camada de valência.
Os elétrons da camada de valência são os que participam das ligações, pois são os mais externos.
Camadas da eletrosfera
Conforme o modelo atômico de Rutherford-Bohr, os elétrons giram ao redor do núcleo atômico, em diferentes camadas energéticas.

Existem sete camadas designadas pelas letras K, L ,M, N, O, P e Q. Cada uma suporta um número máximo de elétrons.
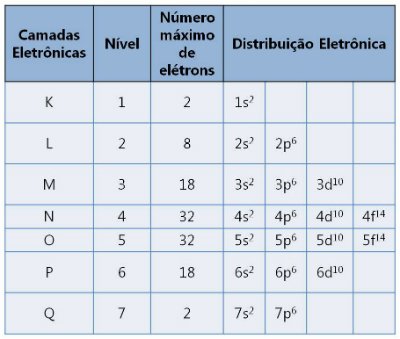 Camadas eletrônicas e os números de elétrons que suportam
Camadas eletrônicas e os números de elétrons que suportam
As camadas eletrônicas são designadas pelas letras K, L, M, N, O, P, Q, correspondendo aos níveis de energia 1 a 7. O número de níveis depende do número de elétrons do átomo:
- Camada K (1º nível): Máximo de 2 elétrons.
- Camada L (2º nível): Máximo de 8 elétrons.
- Camada M (3º nível): Máximo de 18 elétrons.
- Camada N (4º nível): Máximo de 32 elétrons, e assim por diante.
Contudo, vale lembrar que existe outro valor de elétrons para camadas mais externas. Esses valores são obtidos pela equação de Rydberg (2n2), no 5º nível, por exemplo, o número máximo de elétrons seriam 50. Porém, o que se percebe experimentalmente é a presença de 32 elétrons no 5º nível.
A camada de valência de um elemento determina como ele interage quimicamente com outros elementos, sendo fundamental na formação de ligações iônicas e ligações covalentes.
Aproveite para aprofundar os seus estudos sobre a Regra do Octeto.
Como determinar a Camada de Valência
A camada de valência pode ser determinada de duas formas: Distribuição Eletrônica e Tabela Periódica.
Através da distribuição eletrônica
Para determinação da camada de valência através da distribuição eletrônica é usado o Diagrama de Linus Pauling.
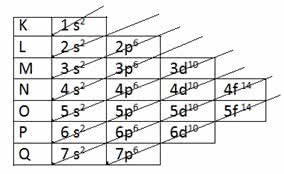 Diagrama de Pauling
Diagrama de Pauling
Lembre-se que o diagrama de Pauling segue a ordem crescente de energia. A última camada obtida na distribuição eletrônica é a camada de valência.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Assim, na camada de valência, o subnível mais energético é a última camada.
Passo 1: identifique o número atômico do elemento (Z)
O número atômico (Z) de um elemento representa o número de prótons no núcleo e, em um átomo neutro, é igual ao número de elétrons. Entende-se como átomo neutro àquele que não possui carga negativa ou positiva no canto superior direito.
O número atômico é encontrado na tabela periódica.
Exemplo: O número atômico do oxigênio (O) é 8, o que significa que o átomo de oxigênio tem 8 elétrons.
Passo 2: organize os elétrons nos níveis de energia
Os elétrons ocupam níveis de energia específicos ao redor do núcleo, e esses níveis são divididos em camadas eletrônicas. Cada camada tem uma capacidade máxima de elétrons:
- 1ª camada (K): até 2 elétrons.
- 2ª camada (L): até 8 elétrons.
- 3ª camada (M): até 18 elétrons.
- 4ª camada (N): até 32 elétrons, e assim por diante.
Para distribuir os elétrons de um átomo, devemos preencher as camadas eletrônicas respeitando esses limites, do nível mais baixo (mais próximo ao núcleo) para o mais alto.
Passo 3: faça a distribuição eletrônica
Agora, distribua os elétrons do átomo nas camadas eletrônicas, respeitando a capacidade de cada camada. A notação que usamos para isso é baseada nos subníveis de energia (s, p, d, f).
Os subníveis têm a seguinte capacidade:
- s: 2 elétrons
- p: 6 elétrons
- d: 10 elétrons
- f: 14 elétrons
A distribuição eletrônica segue a sequência de preenchimento de acordo com a regra de Aufbau (que indica a ordem crescente de energia dos orbitais). A ordem de preenchimento mais comum é a seguinte:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s, etc.
Passo 4: identifique a última camada (Camada de Valência)
A última camada preenchida na distribuição eletrônica é a camada de valência. Os elétrons nesta camada são os que determinam as propriedades químicas do elemento.
Exemplos:
Nitrogênio - N
Número Atômico: 7
Distribuição eletrônica: 1s2 2s2 2p3
Camada de Valência: 2s2 2p3. Há 5 elétrons na camada de valência do Nitrogênio.
Ferro - Fe
Número Atômico: 26
Distribuição eletrônica: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Camada de Valência: 4s2. Há 2 elétrons na camada de valência do Ferro.
Cloro - Cl
Número Atômico: 17
Distribuição eletrônica: 1s2 2s2 2p6 3s2 3p5
Camada de Valência: 3s2 3p5. Há 7 elétrons na camada de valência do Cloro.
Oxigênio - O
Número atômico: 8
Distribuição eletrônica: 1s2 2s2 2p4
Camada de Valência: 2s2 2p4. Há 6 elétrons na camada de valência do Oxigênio.
Carbono - C
Número atômico: 6
Distribuição eletrônica: 1s2 2s2 2p2
Camada de Valência: 2s2 2p2. Há 4 elétrons na camada de valência do Carbono.
Leia também sobre Números Quânticos.
Até agora, os exemplos usados foram com elementos em estado fundamental. Mas o mesmo princípio pode ser usado para os íons, cátions e ânions. Íons são elementos que perderam ou ganharam elétrons. Dessa maneira, são diferentes do elemento no estado fundamental.
Quando um elemento perde elétron ele se torna positivo, pois os elétrons possuem carga negativa. Um elemento com carga positiva se chama cátion. Os ânions são elementos negativos, isto é, quando ganham elétrons.
Veja um exemplo de cada:
Ânion Cloreto: Cl-
O número atômico do Cloro é 17. Se estivesse em seu estado fundamental, o número de elétrons seria igual ao de prótons. Porém, nesse caso há o ganho de 1 elétron.
Primeiramente, faça a distribuição eletrônica para o elemento Cloro:
1s2 2s2 2p6 3s2 3p5
Com o ganho de um elétron a mais, acrescente na última camada:
1s2 2s2 2p6 3s2 3p6. Assim, existem 8 elétrons na camada de valência (3s2 3p6).
Cátion de Cálcio: Ca2+
O número atômico do Cálcio é 20. Dessa forma, sua quantidade de elétrons também seria igual, isso se o elemento estivesse no estado fundamental. Contudo, o Cálcio está ionizado, ou seja, ele perdeu dois elétrons, pois está duas vezes positivo.
Sabendo disso, realiza-se a distribuição eletrônica normalmente dos 20 elétrons, lembrando de remover dois ao final, na última camada. Veja:
1s2 2s2 2p6 3s2 3p6 4s2 (Somando os expoentes temos 20 elétrons).
Como se trata de um cátion, ou seja, de um íon positivo, será necessário o ajuste de elétrons. Nesse caso, o Cálcio perde 2 elétrons. Realizando novamente a distribuição temos:
1s2 2s2 2p6 3s2 3p6 (Somando os expoentes temos 18 elétrons).
No Cálcio com 20 elétrons distribuídos há apenas 2 elétrons na camada de valência, porém, quando se desfaz desses dois elétrons as coisas mudam.
A partir da doação de elétrons, o Cálcio se estabiliza com 8 elétrons na camada de valência que passa a ser a terceira (3s2 3p6).
Aprofunde os seus estudos sobre Distribuição Eletrônica e faça Exercícios sobre distribuição eletrônica.
Através da Tabela Periódica
Para determinar a camada de valência através da tabela periódica é preciso identificar o período e a família do elemento.
Passo 1: entenda a estrutura da tabela periódica
A tabela periódica é organizada em períodos (linhas horizontais) e grupos (colunas verticais). Cada parte da tabela fornece informações sobre os níveis de energia (camadas eletrônicas) e os elétrons de valência.
Períodos: indicam o número de camadas eletrônicas que o átomo possui. Por exemplo, os elementos do período 2 têm 2 camadas eletrônicas, enquanto os do período 3 têm 3 camadas, e assim por diante.
Grupos: indicam o número de elétrons de valência (aplica-se aos grupos do bloco s e p, que são os mais comuns). Esses elétrons estão localizados na camada de valência e determinam como o elemento se comporta quimicamente.
Passo 2: determine o período (Nível de Energia ou Número de Camadas)
O período em que o elemento está localizado indica quantas camadas eletrônicas ele possui. Por exemplo:
Elementos do período 2 têm 2 camadas eletrônicas.
Elementos do período 3 têm 3 camadas eletrônicas, e assim por diante.
Passo 3: determine o grupo (Número de Elétrons de Valência)
Os grupos da tabela periódica, especialmente nos blocos s e p (grupos 1, 2 e 13-18), indicam o número de elétrons de valência que o elemento possui.
- Grupo 1 e 2 (Bloco s):
- Grupo 1: os elementos têm 1 elétron de valência (ex: H, Li, Na).
- Grupo 2: os elementos têm 2 elétrons de valência (ex: Be, Mg, Ca).
- Grupo 13 a 18 (Bloco p):
- Grupo 13: os elementos têm 3 elétrons de valência (ex: B, Al).
- Grupo 14: os elementos têm 4 elétrons de valência (ex: C, Si).
- Grupo 15: os elementos têm 5 elétrons de valência (ex: N, P).
- Grupo 16: os elementos têm 6 elétrons de valência (ex: O, S).
- Grupo 17: os elementos têm 7 elétrons de valência (ex: F, Cl).
- Grupo 18: os elementos têm 8 elétrons de valência (exceto o Hélio, que tem 2) e são chamados de gases nobres, pois são estáveis e geralmente não reagem.
Exemplos Práticos
1. Oxigênio (O)
O oxigênio está no período 2, o que significa que ele tem 2 camadas eletrônicas.
Ele pertence ao grupo 16, o que indica que tem 6 elétrons de valência.
Conclusão: o oxigênio tem 2 camadas eletrônicas e 6 elétrons na última camada (camada de valência).
2. Sódio (Na)
O sódio está no período 3, o que indica que ele possui 3 camadas eletrônicas.
Ele pertence ao grupo 1, o que indica que tem 1 elétron de valência.
Conclusão: o sódio tem 3 camadas eletrônicas, e apenas 1 elétron na última camada (camada de valência).
3. Cloro (Cl)
O cloro está no período 3, indicando que possui 3 camadas eletrônicas.
Ele pertence ao grupo 17, o que significa que tem 7 elétrons de valência.
Conclusão: o cloro tem 3 camadas eletrônicas, e 7 elétrons na última camada (camada de valência).
Aprofunde os seus conhecimentos sobre a família da tabela periódica e Ligações Químicas.
Leia também sobre Geometria Molecular.
Exercícios
1. Encontre a camada de valência dos seguintes elementos:
Bromo
Alumínio
2. (UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
3. (IFSP/2013) O número de elétrons da camada de valência do átomo de cálcio (Z = 20), no estado fundamental, é
a) 1
b) 2
c) 6
d) 8
e) 10
4. Marque a opção que contenha a distribuição correta do Alumínio () em estado de ionização.
a) 1s2 2s2 2p6 3s2 3s1
b) 1s2 2s2 2p6
c) 1s2 2s2 2p6 3s2 3s6 4s2 3d7
d) 1s2 2s2 2p5
e) 1s2 2s2 2p6 3s2 3s2
Resposta correta: letra b - 1s2 2s2 2p6
O Alúminio da questão não está no estado fundamental. Essa é uma importante observação a ser feita, pois ele tem uma carga 3+. Isso significa que o Alumínio está ionizado, como um cátion, ou seja, como um íon positivo.
Dessa maneira, o Alumínio perdeu 3 elétrons, uma vez que ele se encontra na sua forma 3+. Logo, para a realização da distribuição eletrônica será necessário descontar, subtrair, 3 elétrons do total do número atômico (Z). Para sua ciência, o Z (número atômico) fica posicionado no canto inferior esquerdo do símbolo do elemento, é uma regra.
5. Sabendo que o Potássio possui Z = 19. Baseado nessa informação marque a alteranativa que contenha o grupo da tabela periódica desse elemento.
a) Há 2 elétrons na camada de valência, portanto grupo 2.
b) Há 2 elétron na camada de valência, portanto grupo 1.
c) Há 1 elétrons na camada de valência, portanto grupo 1.
d) Há 1 elétron na camada de valência, portanto grupo 2.
e) Há 2 elétrons na camada de valência, portanto grupo 2A.
Resposta correta: letra c. Há 1 elétron na camada de valência, portanto grupo 1.
Isso acontece, pois a quantidade de elétrons de valência definem o posicionamento do átomo nas colunas (vertical). Enquanto que, os períodos (horizontais) são definidas pela quantidade de camadas que há no átomo. A camada mais externa, a de valência, define a período do átomo da tabela.
6. Um elemento no grupo 17 precisa de quantos elétrons para completar a Regra do Octeto?
a) 1 elétron
b) 2 elétrons
c) 3 elétrons
d) 4 elétrons
e) perder 1 elétron
Reposta correta: letra a. 1 elétron.
Todos os elementos que estão na coluna (vertical) 17 (antigo 7A) possuem 7 elétrons na camada de valência. Logo, para completar seu octeto, precisam de apenas mais 1 elétron.
Confira questões de vestibulares com resolução comentada em: Exercícios sobre a Tabela Periódica.
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005.
CASTILHO, Rubens. Camada de Valência. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/camada-de-valencia/. Acesso em:


