Concentração comum: o que é, como calcular e exercícios resolvidos
A concentração comum, também chamada de concentração em g/L, consiste na relação entre a massa de soluto existente em um volume de solução.
Matematicamente, a concentração comum é expressa através da fórmula:
C = m/V
Onde,
C: concentração comum;
m: massa do soluto;
V: volume da solução.
A unidade mais utilizada para concentração comum é g/L, pois a massa de soluto é calculada em gramas (g) e o volume de solução em litros (L).
Por exemplo, a água do mar apresenta grande quantidade de sais dissolvidos e o cloreto de sódio (NaCl), conhecido popularmente como sal de cozinha, é um deles.
A concentração do cloreto de sódio na água do mar é, em média, de 2,5 g/L. Sendo assim, existem 2,5 gramas de sal, que é o soluto, em cada 1 litro de água do mar, que é a solução.
Como calcular a concentração comum?
Uma solução é uma mistura homogênea formada por uma substância em menor quantidade, chamada de soluto, dissolvida em um solvente, que está em maior quantidade.
Por isso, a concentração comum refere-se à quantidade de soluto em determinado volume de solução. Quanto mais soluto dissolvido na solução, mais concentrada ela é. Caso contrário, ou seja, pouco soluto indica que a solução é diluída.
Exemplo 1: Qual a concentração em g/L de uma solução de iodeto de prata (AgI) contendo 2,6 g em 1L de solução?
Quando nos é dada a quantidade de soluto e o volume da solução, basta aplicarmos os valores na fórmula de concentração comum para encontrar o seu valor.
Portanto, em uma solução 2,6 g/L de iodeto de prata existem 2,6 g de soluto em cada 1 litro de solução.
Exemplo 2: Ao evaporar o solvente de 500 mL de solução salina com concentração de 6 g/L, qual a massa de soluto obtida?
Note que em alguns cálculos, podemos encontrar a concentração comum descrita para que possamos calcular a massa de soluto.
É necessário também ficar atento às unidades. Como a concentração comum é dada em g/L, neste caso, precisamos converter a unidade de volume antes de aplicar a fórmula.
Como 1 L contém 1000 mL, então 500 mL corresponde a 0,5 L.
Sendo assim, ao evaporar o solvente da solução com concentração 6 g/L, foi obtido 3 g de soluto.
Adquira mais conhecimento com os conteúdos:
Exercícios resolvidos de concentração comum
Aproveite as questões a seguir para verificar os conhecimentos adquiridos anteriormente.
Questão 1
(Unicamp) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de MgCl2 de concentração 8,0 g/L. Quantos gramas de soluto são obtidos?
a) 8,0
b) 6,0
c) 4,0
d) 2,0
e) 1,0
Questão 2
Observe a imagem a seguir.
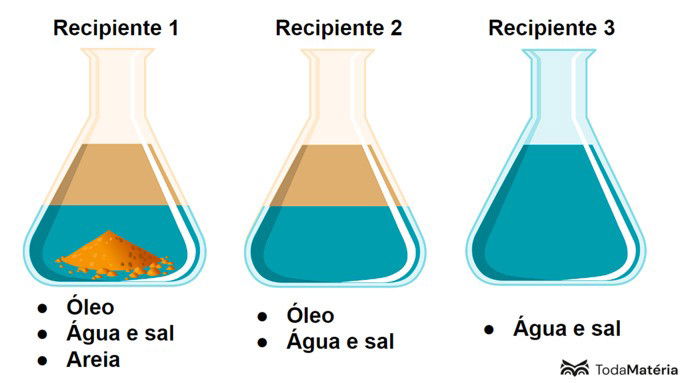
Nesse esquema, o recipiente 3 contém uma
a) Mistura heterogênea
b) Substância pura
c) Solução
d) Mistura coloide
Questão 3
Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de magnésio MgCl2 até atingir a concentração 2,0 g/L. Qual o volume de solução foi preparado?
a) 1 L
b) 2 L
c) 4 L
d) 6 L
Confira mais questões com resolução comentada em exercícios sobre concentração comum e exercícios sobre soluções.
Referências Bibliográficas
FONSECA, M. R. M. Química, 1. 1. ed. São Paulo : Ática, 2013.
SANTOS, W.L.P; MOL, G.S. Química cidadã, 1. 2. ed. São Paulo: Editora AJS, 2013.
USBERCO, J. Conecte química, 1. 2. ed. São Paulo: Saraiva, 2014.
BATISTA, Carolina. Concentração comum: o que é, como calcular e exercícios resolvidos. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/concentracao-comum/. Acesso em:


