Densidade: o que é, como calcular, exemplos e exercícios
A densidade é a relação da massa de matéria em um determinado volume. Trata-se de uma propriedade específica que considera a razão entre a massa (m) e o volume (v) de um material.
Matematicamente, essa grandeza é calculada pela fórmula:
Onde,
- d = densidade
- m = massa
- v = volume
A unidade utilizada no Sistema Internacional (SI) para expressar a densidade é o quilograma por metro cúbico (kg/m3). Entretanto, frequentemente essa grandeza é indicada em grama por centímetro cúbico (g/cm3) ou em grama por mililitro (g/mL).
Como exemplo, observe a densidade dos materiais a seguir.
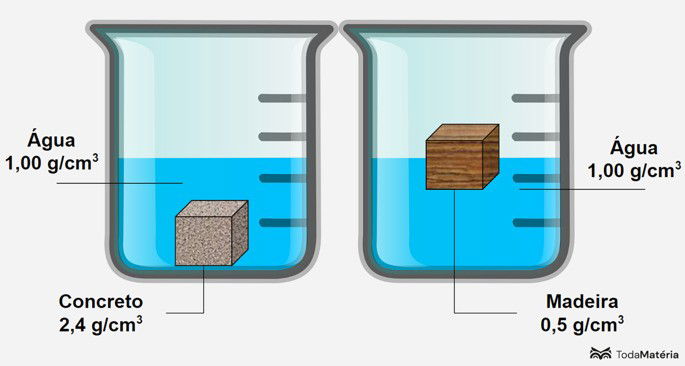
Como o concreto é mais denso que a água, ele afunda. A madeira flutua porque sua densidade é menor que a da água.
Tabela com exemplos de densidade
Tomando como exemplo dois materiais, madeira e concreto, sabemos que dois quilos de madeira tem a mesma massa que dois quilos de concreto.
A diferença está no volume ocupado pelos materiais. É preciso um volume de madeira muito maior do que o volume de concreto, afinal, o concreto é mais "concentrado", ou seja, a sua densidade é maior.
| Densidade de alguns materiais em g/cm3 a 25ºC | |
|---|---|
| Aço | 7,8 |
| Água | 1,0 |
| Chumbo | 11,3 |
| Cobre | 8,96 |
| Concreto | 2,4 |
| Etanol | 0,789 |
| Ferro | 7,87 |
| Gelatina | 1,27 |
| Glicerina | 1,26 |
| Leite | 1,03 |
| Madeira | 0,5 |
| Mercúrio | 13,5 |
| Ouro | 19,3 |
| Platina | 21,5 |
| Quartzo | 2,65 |
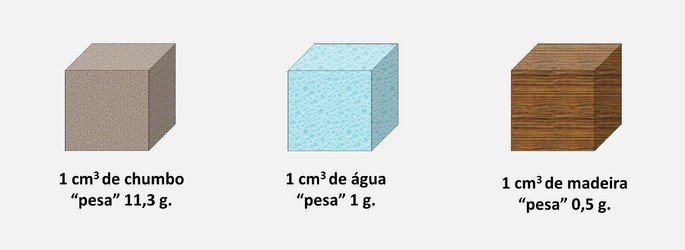
Utilizando os exemplos da tabela anterior, podemos interpretar a densidade da seguinte forma:
Saiba mais sobre Propriedades da Matéria.
Fatores que afetam a densidade
Tipo de material: como a densidade é uma propriedade específica, cada material apresenta um valor de densidade.
Por exemplo, o ouro possui densidade de 19,3 g/cm3 e a prata tem densidade de 10,5 g/cm3.
Temperatura: o aumento da temperatura faz com que a densidade diminua, pois densidade e temperatura são grandezas inversamente proporcionais.
Por exemplo, a densidade da água varia conforme a temperatura. Na temperatura de 15 ºC a densidade é de 0,9991 g/cm3 e o valor de 0,9956 g/cm3 é atingido à temperatura de 30 °C.
Estado físico: a mudança de estado físico altera a disposição das moléculas e influencia a densidade.
Por exemplo, a água em estado sólido flutua na água que está em estado líquido. A densidade da água é 1 g/cm3, já o gelo tem uma densidade de 0,92 g/cm3.
Pressão: como o volume é uma grandeza que varia de acordo com a temperatura e pressão, quando a pressão diminui a densidade aumenta.
Por exemplo, os gases sofrem forte influência da pressão. O ar seco tem densidade de 1,2754 kg/m3 em 0 °C e 100 kPa. Sua densidade diminui para 1,2041 kg/m3 nas condições de 20 °C e 101,325 kPa.
Leia também sobre propriedades gerais da matéria.
Densidade absoluta e densidade relativa
Quando falamos simplesmente em densidade, estamos nos referindo à densidade absoluta ou massa específica, que como vimos, resulta da divisão da massa sobre o volume de um material.
A densidade relativa (), por sua vez, respeita à relação comparativa entre a densidade de um material com a de outro. A fórmula é a seguinte:
ou seja,
Densidade na tabela periódica
A densidade é uma característica dos elementos químicos. A variação da densidade absoluta, no estado sólido, é uma propriedade periódica que aumenta de cima para baixo (vertical) e das extremidades para o centro (horizontal) na Tabela Periódica.
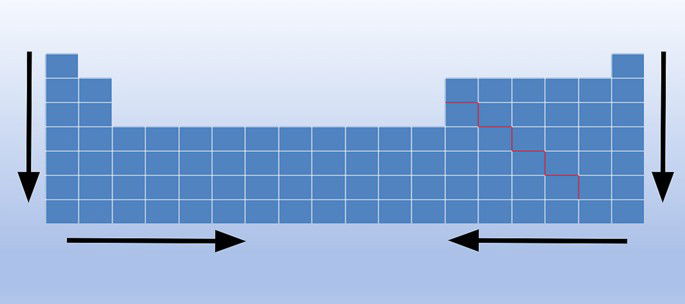
Como podemos observar, os elementos mais densos estão no centro e na parte inferior da tabela. Por exemplo:
- Ósmio (Os): d = 22,61 g/cm3
- Irídio (Ir): d = 22,65g/cm3
Saiba mais em Propriedades Periódicas.
Exercícios de densidade
Questão 1
(UFU) Em condições ambientes, a densidade do mercúrio é de aproximadamente 13 g/cm3. A massa desse metal, da qual um garimpeiro de Poconé (MT) necessita para encher completamente um frasco de meio litro de capacidade, é de:
a) 2.600 g
b) 3.200 g
c) 4.800 g
d) 6.500 g
e) 7.400 g
Questão 2
(FMTM) Considere as substâncias e suas respectivas densidades à temperatura ambiente:
| Substância | Densidade (g/mL) |
|---|---|
| Ácido sulfúrico | 1,8410 |
| Tolueno | 0,8669 |
| Acetona | 0,7899 |
Há maior massa em um litro de:
a) ácido sulfúrico que em dois litros de tolueno.
b) tolueno que em dois litros de acetona.
c) acetona que em dois litros de tolueno.
d) ácido sulfúrico que em três litros de acetona.
e) tolueno que em dois litros de ácido sulfúrico.
Continue testando seus conhecimentos com essas listas de exercícios que preparamos pra você:
- Exercícios sobre densidade
- Exercícios sobre propriedades da matéria
- Exercícios sobre a tabela periódica
- Exercícios sobre separação de misturas
- Exercícios de Física (resolvidos) para 1º ano do ensino médio.
Referências Bibliográficas
ATKINS, P.W.; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006.
FELTRE, Ricardo. Fundamentos de Química: vol. único. 4ª.ed. São Paulo: Moderna, 2005.
Lee, J. D. Química inorgânica não tão concisa. Tradução da 5ª ed. inglesa. Editora Edgard Blücher Ltda. 1999.
BATISTA, Carolina. Densidade: o que é, como calcular, exemplos e exercícios. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/densidade/. Acesso em:


