Energia de Ionização
Energia de Ionização é uma propriedade periódica que indica qual a energia necessária para transferir o elétron de um átomo em estado fundamental.
Um átomo encontra-se no seu estado fundamental quando o seu número de prótons é igual ao seu número de elétrons.
A transferência de elétron(s) do átomo é chamada de ionização. Por isso, a energia necessária para que ela aconteça recebe o nome de energia de ionização, também conhecida como Potencial de Ionização.
O primeiro elétron retirado é aquele que se encontra mais distante do núcleo do átomo. A distância facilita a transferência porque, quanto mais distante do núcleo, que é positivo, menos energia será necessária para que o elétron seja retirado dele.
O(s) elétron(s) seguinte(s) precisam de mais energia. Assim, podemos dizer que a 1.ª energia de ionização (E.I) é menor do que a 2.ª energia de ionização. A 2.ª, por sua vez, é menor do que a 3.ª energia de ionização e assim sucessivamente:
1.ª E.I < 2.ª E.I < 3.ª E.I ...
Isso acontece porque o raio atômico aumenta de tamanho na medida em que cada elétron é retirado do átomo. Com isso, os elétrons ficam cada vez mais próximos do núcleo atômico.
Confira quais as energias de Ionização sucessivas do oxigênio:
O -› O+ : 1313.9 kJ mol-1
O+1 -› O+2 : 3388.2 kJ mol-1
O+2 -› O+3 : 5300.3 kJ mol-1
O+3 -› O+4 : 7469.1 kJ mol-1
O+4 -› O+5 : 10989.3 kJ mol-1
Quando, após a retirada de um elétron, o átomo fica com mais prótons do que elétrons esse átomo passa a ser um cátion.
Leia também:
É o que acontece, por exemplo, quando retiramos um elétron do hidrogênio. O hidrogênio é composto por 1 próton e 1 elétron.
Após retirar o elétron, o hidrogênio fica apenas com um próton no seu núcleo. Quer dizer que o hidrogênio foi ionizado e que se tornou um cátion, que é o mesmo que dizer que se tornou um íon positivo.
Energia de Ionização na Tabela Periódica
O raio atômico aumenta nos sentidos da direita para a esquerda e de cima para baixo na tabela periódica.
Sabendo isso, a energia de ionização aumenta no sentido inverso, ou seja, ela é maior da esquerda para a direita e de baixo para cima.
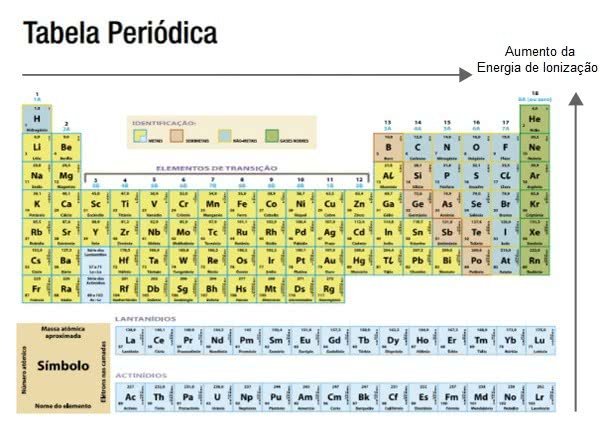
Dentre os elementos que precisam de menos energia de ionização estão os metais alcalinos, por exemplo, o potássio.
Os gases nobres, em geral, são aqueles que requerem uma energia de ionização mais alta, por exemplo, o argônio.
Energia de Remoção x Energia de Ionização
A energia de remoção é muito semelhante à energia de ionização. A diferença entre ambas é que a energia de remoção pode estar associada a efeitos fotoelétricos.
Efeitos fotoelétricos são elétrons geralmente emitidos por materiais metálicos expostos à luz.
Em decorrência disso, na energia de remoção a retirada dos elétrons não obedece uma sequência tal como acontece com a energia de ionização.
Na energia de ionização, os primeiros elétrons retirados são os mais distantes do núcleo.
Afinidade Eletrônica
A afinidade eletrônica também influencia o comportamento dos átomos, mas de maneira inversa.
Essa é a propriedade periódica que indica a energia liberada quando um átomo recebe um elétron. Por outro lado a energia de ionização é a energia necessária para retirar um elétron de um átomo.
Leia também Eletropositividade e Eletronegatividade.
Exercícios
1. (PUCRS) Considerando-se a posição dos elementos na tabela periódica, é correto afirmar que, entre os elementos indicados a seguir, o de menor raio e maior energia de ionização é o
a) alumínio
b) argônio
c) fósforo
d) sódio
e) rubídio
2. (UEL) Na classificação periódica, a energia de ionização dos elementos químicos AUMENTA
a) das extremidades para o centro, nos períodos.
b) das extremidades para o centro, nas famílias.
c) da direita para a esquerda, nos períodos.
d) de cima para baixo, nas famílias.
e) de baixo para cima, nas famílias.
3. (Uece) Sejam os seguintes átomos neutros representados pelos símbolos hipotéticos X, Y, Z e T e suas respectivas configurações eletrônicas:
X → 1s2
Y → 1s2 2s2
Z → 1s2 2s2 2p6 3s2 3p6
T → 1s2 2s2 2p6 3s2 3p6 4s2
O que apresenta maior energia de ionização é:
a) Y
b) Z
c) T
d) X
4. (Ufes) A primeira energia de ionização de bromo (Z=35) é 1.139,9kJ/mol. Assinale a alternativa que contenha as primeiras energias de ionização do flúor (Z=9) e do cloro (Z=17), respectivamente, em kJ/mol.
a) 930,0 e 1.008,4
b) 1.008,4 e 930,0
c) 1.251,1 e 1.681,0
d) 1.681,0 e 1.251,1
e) 1.251,0 e 930,0
Confira questões de vestibulares com resolução comentada em: Exercícios sobre a Tabela Periódica.
Energia de Ionização. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/energia-de-ionizacao/. Acesso em:

