O Elemento Químico Enxofre
O enxofre é um elemento químico que tem como símbolo o S. Na tabela periódica, ele faz parte dos não-metais, na família dos calcogênios (família VI A).
Você sabia?
O símbolo do enxofre é S uma vez que o termo vem da palavra latina sulphur.
Características do Enxofre

- Em temperatura ambiente seu estado é sólido
- É um não-metal insípido e inodoro
- Possui coloração amarelo-limão
- Ele é insolúvel em água
- Seu número atômico é 16 (16 prótons e 16 elétrons)
- Sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p4
- Sua densidade é de 1,96 g/cm3
- O ponto de fusão (PF) é 388,36 K
- O ponto de ebulição (PE) é 717,87 K
- Sua massa atômica é 32 u
Quer saber mais? Leia os artigos:
Alotropia do Enxofre
A alotropia é a variação do número de átomos que acontecem com alguns elementos químicos, formando uma ou mais substâncias simples diferentes.
Sendo assim, as formas alotrópicas do enxofre são as moléculas de S2, S4, S6 e S8.
Dióxido de Enxofre
Quando o enxofre se mistura com o oxigênio ele forma o anidrido sulfuroso, também conhecido pelo nome dióxido de enxofre (SO2). Esse gás é tóxico e possui cheiro de ovo podre.
S(s) + O2(g) → SO2(g)
Em contato com a água ele gera o ácido sulfuroso ou sulfúrico:
SO2(g) + H2O → H2SO3(aq)
Trióxido de Enxofre
Quando ocorre a oxidação do dióxido de enxofre temos o trióxido de enxofre:
SO2(s) + O2(g) → SO3(s)
Para que serve o enxofre?
Vale destacar que o enxofre é um elemento químico essencial para todos os organismos vivos. Ele favorece o funcionamento do corpo, pois regula a glicose, auxilia no transporte de minerais, potencializa a ação das vitaminas, etc.
A diminuição de enxofre no organismo pode gerar alguns problemas relacionados com os ossos, pele, cabelo e unhas. Alguns alimentos ricos em enxofre são: feijão, lentilha, couve, brócolis, espinafre, alho, cebola, castanha, etc.
Além de estar presente em muitos aminoácidos (cistina, cisteína e metionina), o enxofre é um mineral encontrado na crosta terrestre. Geralmente está presente em regiões vulcânicas, em fontes de águas quentes, no petróleo e no gás natural.
Com o enxofre são produzidos fertilizantes, inseticidas, fungicidas, pólvora, laxantes, cosméticos, etc. Ele é usado em processos industriais, sobretudo quando forma o ácido sulfúrico (H2SO4). Nesse caso, ele é empregado na produção de baterias e vulcanização da borracha.
O sabonete de enxofre é utilizado para curar problemas relacionados com a pele: acne, manchas, eczemas, sarna, dermatite, etc. Além do sabonete, tem o shampoo a base de enxofre que combate a caspa e a dermatite seborreica.
Ciclo do Enxofre
O ciclo do enxofre envolve diversos processos essenciais para a geologia e os seres vivos. Encontrado no solo, ele é absorvido pelas plantas. Já na atmosfera, ele se une ao oxigênio, formando o dióxido de enxofre (SO2 ).
Por fim, ele retorna à atmosfera por meio dos decompositores. Note que com o aumento da queima de combustíveis, ele se concentra na atmosfera, sendo prejudicial para os seres vivos e as plantas. Confira abaixo um esquema sobre seu ciclo:
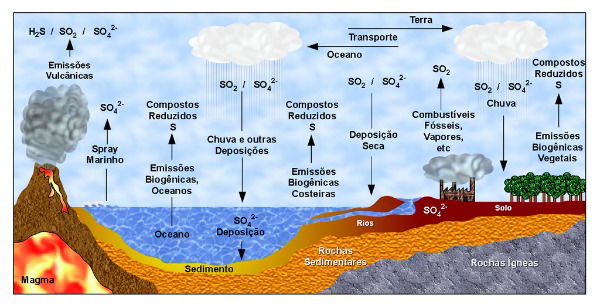
Enxofre como Poluente
A chuva ácida é um tipo de precipitação poluente que ocorre na presença de enxofre. Com o aumento do uso de combustíveis fósseis, termoelétricas e indústrias, há grande concentração de trióxido de enxofre (SO3) na atmosfera. Isso torna a chuva ácida e por isso recebe esse nome.
O Elemento Químico Enxofre. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/enxofre/. Acesso em:

