Equações Químicas: o que são, tipos e como calcular (com exemplos)
As equações químicas são representações gráficas das reações químicas. Essas equações mostram como os elementos presentes na Tabela Periódica interagem entre si.
Elas são usadas para descrever as transformações químicas que ocorrem durante uma reação. Na Tabela Periódica, temos uma lista de todos os elementos que existem, e as equações químicas nos mostram como eles se combinam para formar novas substâncias.
Elas são formadas por átomos, moléculas, e se apresentarem íons são chamadas de equações iônicas:
- H2(g) + O2(g) → H2O (l) – equação comum
- H+ + OH-→ H2O – equação iônica
Observe que os elementos que estão à esquerda da seta são denominados reagentes, os quais participam das reações químicas. Já aqueles que estão à direita são chamados de produtos, ou seja, as substâncias que são formadas a partir dessa reação.
Fique atento, pois alguns símbolos são utilizados nas equações para indicar determinadas ações que ocorrem:
- Quando ocorre a reação química dos elementos: +
- Sentido que ocorre a reação química e indica o que será produzido: →
- Quando há presença de catalisadores ou aquecimento: ∆
- Quando há presença de corrente elétrica: i
- Quando há formação de um sólido que se precipita: ↓
- Quando a reação é reversível: ↔
- Quando há presença de luz: λ
- Elemento no estado gasoso: (g)
- Elemento no estado sólido: (s)
- Elemento no estado de vapor: (v)
- Elemento no estado líquido: (l)
- Presença de solução aquosa: (aq)
Tipos de Equações Químicas
As classificações das equações químicas são determinadas pelo tipo de reação química que ocorre, classificadas de quatro maneiras:
- Reações de Síntese ou Adição (A+B → AB): reação entre duas substâncias gerando uma nova e mais complexa, por exemplo: C + O2 → CO2.
- Reações de Análise ou de Decomposição (AB → A+B): ao contrário da reação de adição, essa reação ocorre de modo que uma substância composta se divide em duas ou mais substâncias simples, por exemplo: 2HgO → 2Hg + O2.
- Reações de Deslocamento ou de Substituição, ou de Simples Troca (AB+C → AC+B ou AB+C → CB+A): corresponde a reação entre uma substância simples e outra composta, resultando na variação da substância composta em simples, por exemplo: Fe + 2HCl → H2 + FeCl2.
- Reações de Dupla-Troca ou de Dupla Substituição (AB+CD → AD+CB): reação entre duas substâncias compostas que trocam entre si os elementos químicos, resultando em duas novas substâncias compostas, por exemplo: NaCl + AgNO3 → AgCl + NaNO3.
Exemplos de Equações Químicas
Veja abaixo alguns exemplos de equações químicas:
C(s) + O2(g) → CO2(g)
2H2(g) + O2(g) → 2 H2O(l)
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Balanceamento das Equações Químicas: Aprendendo a calcular
Uma equação química está devidamente equilibrada e balanceada quando há a mesma quantidade de átomos no lado dos reagentes e do lado dos produtos.
Os coeficientes estequiométricos são os números que aparecem à frente dos elementos, indicando quantos átomos ou moléculas existem na reação.
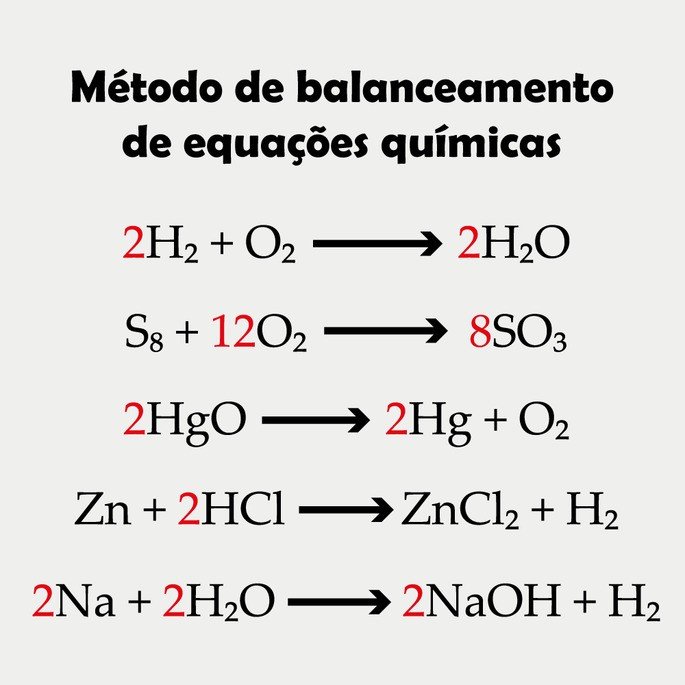
Quando o coeficiente for 1 geralmente ele fica subentendido e não aparece descrito. De tal modo, podemos dizer que as fórmulas (H2, O2, C2, H2O, HCl, CaO, etc.) oferecem um sentido qualitativo, enquanto os coeficientes dão o sentido quantitativo das equações químicas.
Para que uma equação química fique balanceada, devemos atentar para a “Lei da Conservação de Massa” de Lavoisier a qual postula:
“Na natureza nada se cria, nada se perde, tudo se transforma” donde “A soma das massas das substâncias reagentes é igual à soma das massas dos produtos da reação”.
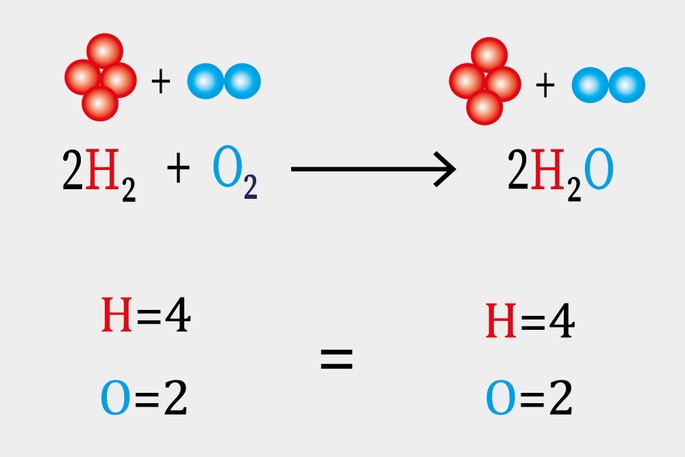
Para entender melhor esse conceito, vejamos o exemplo abaixo:
Para balancear qualquer reação química é interessante verificar a regra MACHO. Com essa regra fica mais fácil saber a ordem de prioridade do balanceamento. Veja:
- M = Metais;
- A = Ametais;
- C = Carbono;
- H = Hidrogênio;
- O = Oxigênio.
Dessa maneira, primeiro devemos verificar os metais da reação, no exemplo acima, o metal é o Alumínio (Al). Portanto, será necessário observar se suas proporções são iguais em ambos os lados da equação, reagentes e produtos.
É possível verificar que no lado dos reagentes existe apenas um Alumínio. Contudo, do lado dos produtos, existem dois, demonstrado por Al2. Esse índice, representado pelo pequeno número no canto inferior direito, significa a quantidade de átomos.
Assim, será necessário o balanceamento do Alumínio, em primeiro lugar, seguindo a regra MACHO. Logo, teremos:
Se observar a equação, não existem outros Ametais, Carbono e Hidrogênio. Logo, o próximo elemento a ser balanceado será o Oxigênio, que sempre será o último a ser calculado.
É possível verificar a presença de 2 Oxigênios nos reagentes e 3 no produto. A primeira vista isso pode parecer complicado de resolver, porém, é algo simples.
Se colocarmos o coeficiente três no Oxigênio presente no lado dos reagentes, teremos:
Logo, 2 Oxigênios da molécula O2 multiplicado por 3, quantidade de moléculas (mol) de O2, é igual a 6 Oxigênios.
Agora, devemos observar o lado do produto. Lá, existem três Oxigênios, no Óxido de Alumínio (Al2O3). Será necessário balancear também. A pergunta que devemos nos fazer é: qual número que multiplicado por três dará seis? Isso porque, existem seis oxigênios nos reagentes e três no produto.
Assim, o resultado será 2. Portanto, devemos incluir o coeficiente dois, na frente do Al2O3. Observe:
Dessa maneira, os Oxigênios dos reagentes e do produto estarão balanceados. Contudo, é possível observar que houve uma quebra na proporção no Alumínio. Segundo as Leis Ponderais, isso não pode ocorrer.
Baseado nisso, devemos retornar ao Alumínio e rebalancear. Se multiplicarmos o coeficiente 2 que está à frente do Al2O3 por 2 Alumínios, teremos um total de 4 átomos de Alumínio. Logo, devemos trocar o coeficiente no lado dos reagentes.
Agora, teremos:
Para finalizar, conferimos os cálculos. Existem 4 átomos de Alumínio no lado dos reagentes, deve existir a mesma quantidade do lado do produto. Se multiplicarmos o coeficiente 2 pela quantidade de Alumínio (Al2), teremos 4. Portanto, o Alumínio está balanceado.
Passemos agora para o Oxigênio. No lado dos reagentes temos o coeficiente 3 que multiplica a quantidade de Oxigênio, que são 2. Logo, o valor é de 6. Portanto, deve haver a mesma quantidade no lado do produto. Podemos conferir multiplicando o coeficiente 2 pela quantidade de átomos de Oxigênio, que são 3. Assim, o resultado é 6, portanto o Oxigênio também está balanceado.
Dessa forma, a equação química está completamente balanceada seguindo os princípios das Leis Ponderais, que são:
- Lei da conservação das massas;
- Lei das proporções definidas;
- Lei das proporções múltiplas.
Exercício Resolvido
Para fixar seus conhecimentos sobre o balanceamento de equações, segue abaixo cinco equações que devem ser balanceadas:
a) H2O → H2+O2
b) H2S+SO2 → H2O+S
c) H2+I2 → HI
d) NH3+O2 → NO+H2O
e) FeS2+O2 → Fe3O4+SO2
Para mais exercícios: Exercícios sobre equações químicas (com gabarito resolvido)
Leia também:
- Fórmulas químicas: entenda o que são e quais as principais (com exemplos)
- Balanceamento de equações químicas
- Reações Químicas
- Cálculos estequiométricos
CASTILHO, Rubens. Equações Químicas: o que são, tipos e como calcular (com exemplos). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/equacoes-quimicas/. Acesso em:


