Evolução dos modelos atômicos
Os modelos atômicos surgiram a partir da necessidade de explicar a estrutura dos átomos. Quando novas evidências sobre a constituição dos átomos eram apresentadas um novo modelo atômico tentava esclarecer as descobertas.
Os filósofos gregos Demócrito e Leucipo no século V a.C. chamaram de átomo, do grego ατoμoν, a partícula indivisível e a menor parte da matéria.
Embora o conceito de átomo seja antigo, o desenvolvimento das teorias atômicas são datadas entre o século XIX e XX. Sendo assim, os principais modelos atômicos desenvolvidos para entender a natureza da matéria foram:
- Modelo atômico de Dalton (1803) — “Modelo bola de bilhar”
- Modelo atômico de Thomson (1898) — “Modelo pudim de passas”
- Modelo atômico de Rutherford (1911) — “Modelo nuclear”
- Modelo atômico de Bohr (1913) — “Modelo planetário”
- Modelo atômico quântico (1926) — “Modelo nuvem eletrônica"
Modelo atômico de Dalton
A primeira tentativa reconhecida de descrever os átomos partiu do cientista inglês John Dalton (1766-1844) em um modelo que ficou popularmente conhecido como “bola de bilhar”.
Átomo de Dalton (1803): esfera maciça, indivisível e indestrutível.

Segundo Dalton:
- Todas as substâncias são formadas por átomos;
- Os átomos de um elemento químico são idênticos no tamanho e nas características, já os de elementos químicos distintos são diferentes;
- As substâncias são resultado de uma reação química, que consiste na recombinação dos átomos.
Pontos negativos: Como os elétrons ainda não eram conhecidos quando Dalton formulou sua teoria, essas partículas, que hoje sabemos que fazem parte dos átomos, não foram consideradas.
Saiba mais sobre o modelo atômico de Dalton.
Modelo atômico de Thomson
Joseph John Thomson (1856‑1940) foi o responsável por descobrir a existência dos elétrons, partículas dotadas de carga negativa e que fazem parte dos átomos. Essa descoberta derrubou a teoria atômica de Dalton, que o átomo é indivisível, mas sim formado por partículas ainda menores e, por isso, ficou conhecido como “pudim de passas”.
Átomo de Thomson (1898): esfera de carga positiva com elétrons fixados.

Segundo Thomson:
- O átomo é eletricamente neutro;
- Os elétrons fixam-se em uma superfície carregada positivamente;
- Existe uma repulsão entre os elétrons distribuídos nos átomos.
Pontos negativos: Embora Thomson levasse em consideração a existência dos elétrons, o átomo não é uma esfera positiva, mas sim dotada de partículas com cargas positivas, os prótons, identificados em 1886 pelo cientista Eugene Goldstein e confirmados posteriormente por Ernest Rutherford.
Saiba mais sobre o modelo atômico de Thomson.
Modelo atômico de Rutherford
Através de seus experimentos Ernest Rutherford (1871‑1937) conseguiu demonstrar que o átomo não era uma partícula indivisível como se acreditava, mas sim que ele era formado por partículas menores.
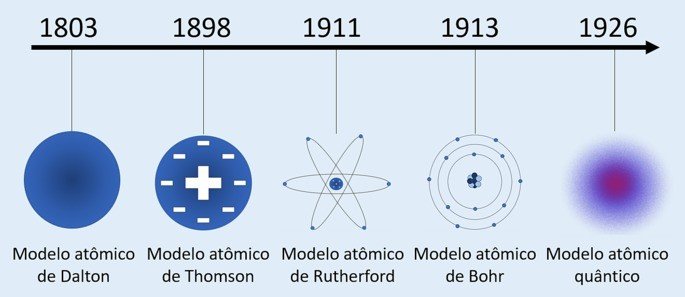
Átomo de Rutherford (1911): núcleo com carga positiva e os elétrons situam-se ao redor dele na eletrosfera.
Segundo Rutherford:
- O átomo apresenta uma região central com alta concentração de carga positiva;
- A massa de um átomo se concentra na sua região central;
- Os elétrons são mais leves e se localizam ao redor do núcleo, região que contém muitos espaços vazios.
Pontos negativos: O núcleo atômico não possui apenas partículas de carga positiva, mas existem também outras partículas subatômicas, os nêutrons, descobertos por James Chadwick em 1932. Além disso, o modelo proposto por Rutherford não explicava a emissão de luz pelos átomos.
Saiba mais sobre o modelo atômico de Rutherford.
Modelo atômico de Bohr
Buscando explicar o porquê dos elementos emitirem cores características quando expostos a algumas condições e baseado no modelo atômico de Rutherford, Niels Bohr (1885-1962) propôs uma teoria atômica que explicava a emissão de luz em certas frequências.
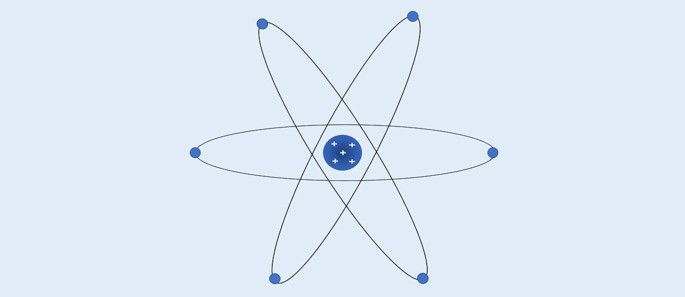
Átomo de Bohr (1913): os elétrons se movimentam em camadas circulares fixas ao redor do núcleo.
Segundo Bohr:
- Os elétrons movimentam-se nas camadas ao redor do núcleo;
- As camadas ao redor do núcleo apresentam valores de energia específicos;
- Para ir para um nível mais externo o elétron deve absorver energia. Ao retornar para uma camada mais próxima do núcleo, o elétron libera energia.
Pontos negativos: Não pode-se afirmar que os elétrons realizam uma trajetória ao redor do núcleo em posições fixas como os planetas ao redor do Sol.
Saiba mais sobre o modelo atômico de Bohr.
Modelo atômico quântico
Muitos cientistas contribuíram para o desenvolvimento da mecânica quântica, que tenta explicar a "mais real" estrutura de um átomo pela combinação de diversos estudos e, por isso, é o mais complexo.
Átomo quântico (1926): o núcleo é formado por prótons (carga positiva) e nêutrons (carga nula), e os elétrons (carga negativa) formam uma nuvem eletrônica ao redor do núcleo.

Segundo o modelo atômico quântico:
- O núcleo é formado por prótons e nêutrons. Como apenas os prótons possuem carga, o núcleo é carregado positivamente;
- Os elétrons formam uma nuvem eletrônica ao redor do núcleo;
- Os elétrons se movimentam em orbitais, num espaço tridimensional;
- A posição exata de um elétron não pode ser definida. O que é feito são cálculos que determinam a probabilidade da região que um elétron estará em dado tempo.
Os números quânticos têm a função de localizar os elétrons. São eles:
O número quântico principal (n) representa os níveis de energia, ou seja, quais as camadas eletrônicas de um átomo.
O número quântico secundário (l) indica os subníveis de energia, ou seja, o subnível de energia a que o elétron pertence.
O número quântico magnético (m) é aquele que indica a órbita onde os elétrons se encontram.
Estude também sobre o Modelo atômico de Schrödinger: o que é e as características da teoria.
Modelos Atômicos no Enem, Como Estudar?
Saiba mais sobre os modelos atômicos e teste seus conhecimentos com:
- Exercício sobre modelos atômicos (com respostas explicadas)
- Exercícios sobre o modelo atômico de Dalton (com respostas explicadas)
- Exercício sobre modelo atômico de Rutherford (com gabarito)
BATISTA, Carolina. Evolução dos modelos atômicos. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/evolucao-dos-modelos-atomicos/. Acesso em:


