4 Experimentos de Química (rápidos e fáceis de fazer)
Os experimentos são uma maneira prática de aprender e testar seus conhecimentos sobre os conceitos estudados na Química.
Aproveite esses experimentos químicos, que podem ser feitos em casa (sob supervisão de adultos) ou trabalhados em sala de aula com o professor, para complementar seus estudos.
1ª experiência – desvendando as cores
Conceitos envolvidos: cromatografia e separação de misturas
Materiais
- canetas (hidrocor) de várias cores
- álcool
- papel-filtro para café
- copo (de vidro para facilitar o acompanhamento do experimento)
Como fazer
- Utilize uma tesoura e recorte tiras do papel-filtro. Para cada canetinha utilizada deve-se fazer um retângulo.
- Agora, numa distância de aproximadamente 2 cm da base, desenhe um círculo com a caneta de cor escolhida e pinte todo o seu interior.
- Cole a ponta do papel mais distante da bolinha desenhada em um suporte. Para isso, você pode utilizar uma fita e fixá-la a um lápis.
- Adicione álcool ao copo, não muito, pois ele deve apenas tocar a extremidade do papel próxima à marca da caneta.
- Coloque o papel no copo de modo que fique na vertical. O lápis que o sustenta deve estar apoiado nas bordas.
- Aguarde entre 10 e 15 minutos até que o álcool suba pelo papel-filtro. Após isso, remova os papéis e deixe-os secar.
Resultado
Quando o álcool passa pela marca da caneta ele interage com os componentes das cores e os conduz pelo papel. Assim, os diferentes pigmentos serão separados pelo contato com o álcool.
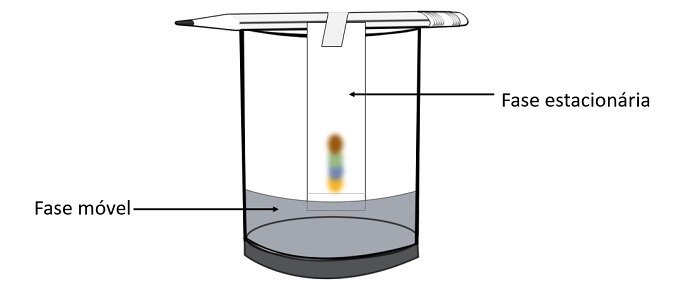
Através desse experimento é possível saber quais cores foram misturadas para criar a cor da canetinha.
Explicação
A cromatografia é um tipo de processo de separação de misturas. O papel-filtro é a fase estacionária e o álcool é a fase móvel que arrasta os componentes da mistura ao passar pela fase estacionária. Nesse processo quanto maior a interação com o álcool mais rápido o pigmento se deslocará com a passagem do solvente.
Os constituintes do material, por possuírem diferentes propriedades, irão interagir com a fase móvel de maneiras distintas, o que pode ser notado pelos diferentes tempos de arraste na fase estacionária.
Saiba mais sobre a cromatografia.
2ª experiência – conservação dos alimentos
Conceitos envolvidos: compostos orgânicos e reações químicas
Materiais
- Maçã, banana ou pera
- Suco de limão ou laranja
- Comprimido de vitamina C
Como fazer
- Escolha uma das três frutas e corte-a em 3 partes iguais.
- O primeiro pedaço servirá de comparação com os demais. Por isso, não adicione nada a ele, apenas deixe-o exposto ao ar.
- Em um dos pedaços goteje o conteúdo de um limão ou de uma laranja. Espalhe de forma que toda a parte interna da fruta seja coberta pelo suco.
- Na última parte espalhe a vitamina C, pode ser um comprimido triturado, em toda a polpa da fruta.
- Observe o que acontece e compare os resultados.
Resultado
A polpa da fruta que ficou exposta ao ar deverá escurecer rapidamente. O suco de limão ou laranja e a vitamina C, composto químico chamado de ácido ascórbico, deverão retardar o escurecimento da fruta.

Explicação
Quando cortamos uma fruta as suas células são danificadas liberando enzimas, como polifenol oxidase, que em contato com o ar oxidam os compostos fenólicos presentes no alimento e provocam um escurecimento enzimático.
Para impedir a ação do oxigênio os conservantes, como o ácido ascórbico, são utilizados por serem preferencialmente oxidados no lugar dos compostos fenólicos. Além do comprimido de vitamina C, o ácido ascórbico também está presente em fontes naturais, como nos citrinos, limão e laranja, sugeridos no experimento.
Saiba mais sobre a oxidação.
3ª experiência – quem congela mais rápido?
Conceitos envolvidos: propriedades coligativas e crioscopia
Materiais
- dois tubetes (utilizados para lembrancinhas)
- travessa de vidro
- sal de cozinha
- água filtrada
- gelo
- termômetro
Como fazer
- Adicione a mesma quantidade de água filtrada nos dois tubos. Por exemplo, 5 mL em cada tubete.
- Adicione o sal de cozinha em um dos tubos e coloque uma fita de identificação para distinguir qual apresenta sal.
- Preencha o recipiente de vidro com gelo picado e adicione um pouco de sal.
- Coloque os dois tubetes simultaneamente dentro do gelo e observe o que acontece.
- Anote a temperatura de congelamento de cada situação.
Resultado
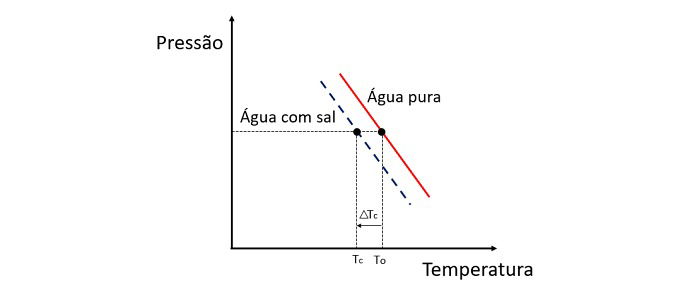
A adição de um soluto na água faz diminuir a temperatura de congelamento. Por isso, a água pura tende a congelar muito mais rápido do que uma solução de água e sal, quando expostas às mesmas condições.
Explicação
Crioscopia é uma propriedade coligativa que estuda a variação da temperatura de um solvente quando diferentes quantidades de soluto são dissolvidas nele.
O abaixamento da temperatura de congelamento da água é causado por um soluto não volátil e esse fenômeno possui muitas aplicações práticas. Portanto, quanto maior a concentração de soluto na solução influencia o efeito crioscópico.
Se, por exemplo, a água congela em 0 ºC e adicionarmos sal a ela, a temperatura de mudança de fase será negativa, ou seja, muito menor.
Esse é o motivo da água do mar não congelar em locais cuja temperatura é inferior a 0 ºC. O sal dissolvido na água tende a diminuir ainda mais a temperatura de congelamento. Em locais onde há neve é também comum jogar sal nas estradas para derreter o gelo e evitar acidentes.
4ª experiência – decomposição da água oxigenada
conceitos envolvidos: reações químicas e catalisador
Materiais
- Metade de uma batata crua e outra metade cozida
- Um pedaço de fígado cru e outro pedaço cozido
- Água-oxigenada
- 2 pratos
Como fazer
- Em cada prato adicione os alimentos, batatas juntas e fígados juntos.
- Em cada um dos quatro materiais adicione 3 gotas de água-oxigenada.
- Observe o que acontece e compare os resultados.
Resultado
A água-oxigenada, uma solução de peróxido de hidrogênio, ao entrar em contato com os alimentos crus começa a apresentar efervescência quase que instantaneamente.
Esse experimento também pode ser feito adicionando um pedaço do alimento em um recipiente com a água oxigenada para tornar a reação mais perceptível.
Explicação
A efervescência apresentada pela água-oxigenada ao entrar em contato com os alimentos crus caracteriza a ocorrência de uma reação química, que é a decomposição do peróxido de hidrogênio e liberação do gás oxigênio.
A decomposição do peróxido de hidrogênio ocorre pela ação da enzima catalase, encontrada na organela peroxissomos, presente em células animais e vegetais.
É importante destacar que a decomposição do peróxido de hidrogênio ocorre espontaneamente, na presença da luz do sol, mas em uma reação muito lenta. Entretanto, a catalase atua como um catalisador, aumentando a velocidade da reação química.
O peróxido de hidrogênio pode ser uma substância tóxica para as células. Por isso, a catalase decompõe o composto e produz água e oxigênio, duas substâncias que não trazem prejuízos ao organismo.
Quando o alimento é cozido seus componentes sofrem alterações. As modificações causadas pelo cozimento também comprometem a ação da catalase pela desnaturação da proteína.
A mesma ação que observamos nos alimentos é o que acontece quando colocamos água-oxigenada em um ferimento. A catalase age e há a formação de bolhas, que consiste na liberação do oxigênio.
Saiba mais sobre as reações químicas
Veja também:
- planos de aula de Química para o 9º ano do Ensino Fundamental
- Materiais utilizados no laboratório de Química
- 5 experimentos científicos fáceis de fazer
- Temas para Feira de Ciências
Referências Bibliográficas
SANTOS, W. L. P.; MÓL, G. S. (Coords.). Química Cidadã. 1. ed. São Paulo: Nova Geração, 2011. v. 1, 2, 3.
SOCIEDADE BRASILEIRA DE QUÍMICA (org.) 2010. A química perto de você: Experimentos de baixo custo para a sala de aula do ensino fundamental e médio. 1. ed. São Paulo.
BATISTA, Carolina. 4 Experimentos de Química (rápidos e fáceis de fazer). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/experimentos-de-quimica/. Acesso em:


