Lei de Avogadro
A Lei de Avogadro, também conhecida como Constante de Avogadro, é um princípio estabelecido em 1811 pelo químico italiano Amedeo Avogadro (1776-1856).
Ela indica que "volumes iguais de dois gases quaisquer nas mesmas condições de pressão e temperatura contêm o mesmo número de mols de moléculas de gás." É representada pelo símbolo NA (ou L).
O Número de Avogadro é o 6,022 x 1023 mol-1 e a indicação matemática da Lei de Avogadro é a seguinte:
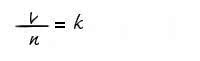
- V é o volume do gás
- n é a quantidade de substâncias do gás
- k é uma constante de proporcionalidade.
O Número de Avogadro é um número padrão para representar um mol de quaisquer entidades elementares de átomos, moléculas, íons e elétrons. A consequência mais importante da Lei de Avogadro é a constante do gás ideal e tem o mesmo valor para todos os gases.
Assim, a Constante de Avogadro é apontada a seguinte maneira:
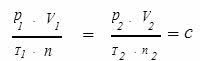
Onde:
- P é a pressão do gás
- t é a temperatura do gás
- c é a constante
O número de Avogadro tem o mesmo valor para todos os gases, independente do tamanho ou massa das moléculas de gás.
Para saber mais, leia também:
Exercícios Resolvidos
Exemplo 1: Como calcular a massa de um átomo de carbono (C)?
Passo 1: Procurar a massa atômica do carbono na tabela periódica
A massa atômica do elemento químico carbono é = 12.01 u
1 mol de carbono é igual a 6,002 x 1023 (Número de Avogadro)
Passo 2: Converter um átomo de carbono em gramas
Massa de C = 12,01 g / 6,022 x 1023 átomos de C
Resposta:
Massa de C = 1,9994 x 10-23 g
Exemplo 2: Quantas moléculas de H20 existem em um floco de neve pesando 1 mg?
Passo 1: Determinar a massa de 1 mol de H20
Como os flocos de neve são feitos de H20, para obter a massa de 1 molécula de água é preciso determinar as massas atômicas do hidrogênio e do oxigênio. Isso é feito a partir da tabela periódica.
Existem dois átomos de hidrogênio e um de oxigênio para cada molécula de H2O, de maneira que a massa de H2O é:
massa de H 2 O 2 = (massa de H) + massa de O
massa de H 2 O = 2 (1,01 g) + 16,00 g
massa de H2O = 2,02 g + 16,00 g
massa de H2O = 18,02 g
Passo 2: Determinar o número de moléculas de H2O em um grama de água
Um mol de H2O equivale a 6,022 x 1023 moléculas de H2O (número de Avogadro). Esta relação é utilizada para converter um número de moléculas de H2O a gramas por a relação:
massa de moléculas X de H2O / X moléculas = massa de um mol de H20 moléculas / 6,022 x 1023 moléculas
Cálculo para X moléculas de H2O:
X moléculas de H2O = (6,022 x 1023 moléculas de H2O) / (massa de um mol de H2O · massa de moléculas X de H2O
Assim:
X moléculas de H2O = (6,022 x 1023 moléculas de H2O) / (18.02g · 1 g)
X moléculas de H2O = 3,35 x 1022 moléculas / grama
Existem 3,35 x 1022 moléculas de H2O em 1 g de H2O.
O nosso floco pesa 1 mg e 1 g = 1,000 mg.
X moléculas de H2O = 3,35 x 1022 moléculas / grama · (1 g / 1000 mg)
Resposta:
Existem 3,35 x 1019 moléculas de H2O em 1 mg de um floco de neve.
Lei de Avogadro. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/lei-de-avogadro/. Acesso em:

