Ligação Iônica
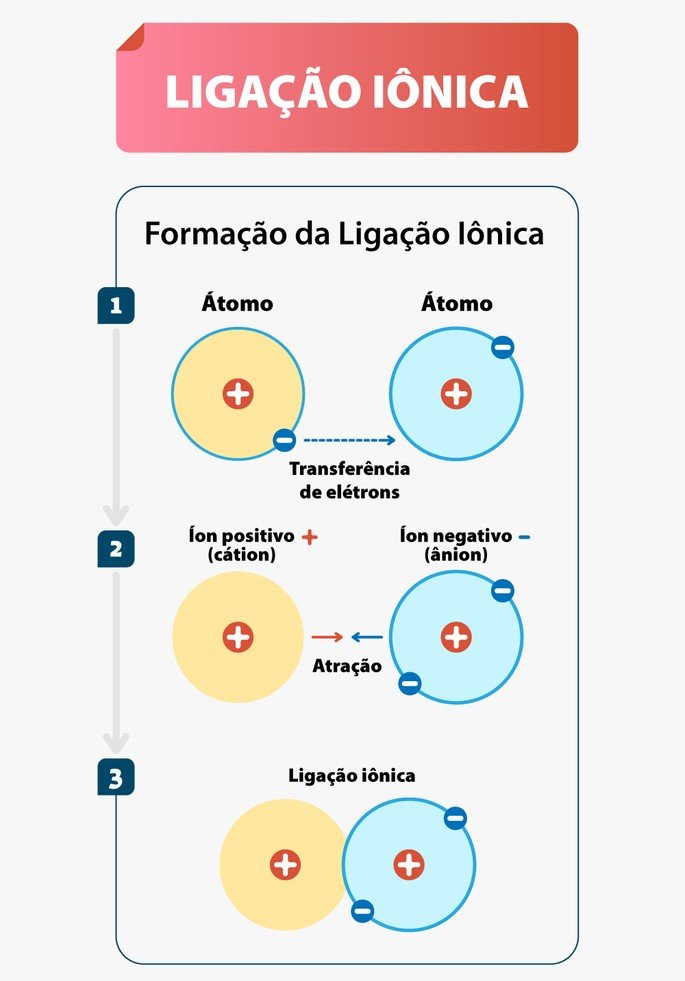
As Ligações Iônicas são as ligações químicas que ocorrem, normalmente, entre metais e ametais. Nessa interação, os metais tendem a doar elétrons e os ametais a receber.
No processo, os elementos envolvidos buscam sua estabilidade química, fato conhecido por: regra do octeto.
Na regra do octeto os elementos buscam atingir oito elétrons em sua camada de valência, isto é, sua última camada eletrônica.
Características das ligações iônicas
Diferente da ligação covalente, em que há compartilhamento, na ligação iônica os elementos envolvidos doam ou perdem elétrons.
Nessa ligação, também conhecida por ligação eletrovalente, ocorre a formação de cátions e ânions. Cátions são os íons positivos e ânions os íons negativos, por esse motivo recebe o nome de ligação iônica.
Isso acontece, pois há doação ou recebimento de elétrons. Como os elétrons são subpartículas com carga negativa, ao doar o átomo fica positivo e, ao receber, negativo.
Portanto, nas ligações iônicas, um ânion se une a um cátion formando um composto iônico por meio da atração eletrostática existente entre eles.
Logo, conclui-se que a ligação iônica é um tipo de ligação química. Essa ligação é baseada na interação eletrostática que acontece pela significativa diferença de eletronegatividade entre os elementos.
Saiba mais: Eletronegatividade.
Os elementos que possuem maior tendência a doar elétrons são:
- Metais Alcalinos, presentes, na tabela periódica, no grupo IA;
- Metais Alcalino-Terrosos, presentes, na tabela periódica, no grupo IIA;
- Família do Boro, presentes, na tabela periódica, no grupo IIIA.
Saiba mais:
Por outro lado, os elementos que possuem maior tendência de ganhar elétrons são:
- Família do Nitrogênio, presentes, na tabela periódica, no grupo VA;
- Calcogênios, presentes, na tabela periódica, no grupo VIA;
- Halogênios, presentes, na tabela periódica, no grupo VIIA.
Vale ressaltar que existem exceções às regras de formação de ligação iônica como, por exemplo, o Cloreto de Ferro (FeCl3).
O Ferro é um metal de transição que, nessa interação específica, se liga a três átomos de Cloro, doando seus três elétrons presentes na camada de valência. Dessa forma, acaba se ionizando, isto é, torna-se um cátion.
Veja também: Cátions e Ânions.
Exemplos de Ligações Iônicas
As ligações iônicas, geralmente estabelecida entre um metal e um ametal (não metal), formam os compostos iônicos.
Os compostos iônicos são sólidos, rígidos e quebradiços, apresentam alto pontos de fusão e ebulição, e conduzem corrente elétrica, quando dissolvidas em água.
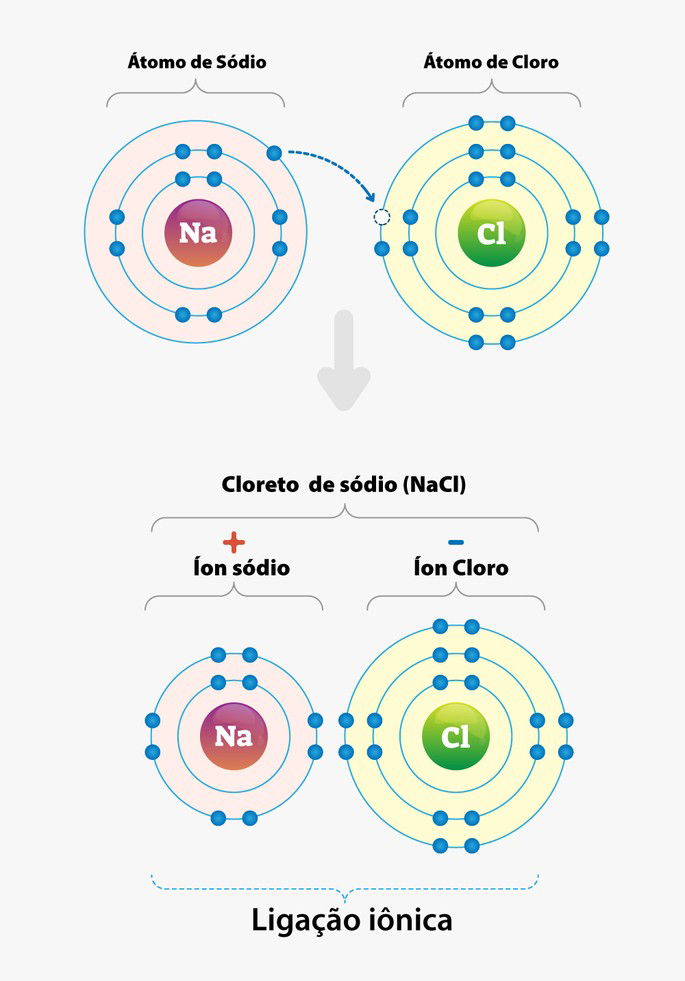
Alguns exemplos de ligações iônicas:
- Na+Cl- = NaCl (Cloreto de sódio ou sal de cozinha)
- Mg2+Cl- = MgCl2 (Cloreto de Magnésio)
- Al3+O2- = Al2O3 (Óxido de Alumínio)
Leia também:
- Exercícios de Ligações Químicas
- Forças Intermoleculares
- Camada de Valência
- Regra do Octeto
- Ligação Covalente
- Ligações Metálicas
- Polaridade das ligações
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005.
MAGALHÃES, Lana. Ligação Iônica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/ligacao-ionica/. Acesso em:



