Ligações Metálicas
As ligações metálicas são tipos de ligações químicas que ocorrem entre metais. Elas formam uma estrutura cristalina chamadas de “ligas metálicas” (união de dois ou mais metais).
Propriedades dos metais
Na tabela periódica, os metais são os elementos da Família I A, chamados de Metais Alcalinos (Lítio, Sódio, etc). Bem como, os elementos da Família II A, os Metais Alcalino-Terrosos (Berílio, Magnésio, etc).
Além disso, no bloco B (grupo 3 ao 12), tem-se a categoria dos “Metais de Transição”. Alguns exemplos são o ouro, prata, cromo, ferro, manganês, níquel, cobre, zinco e platina.
Já os mais importantes elementos que compõem os “Metais Representativos” são: alumínio, gálio, índio, estanho, tálio, chumbo, bismuto.
Os metais são encontrados na natureza no estado sólido (exceto o mercúrio, encontrado no estado líquido). Os metais possuem brilho característico e a facilidade em perder elétrons.
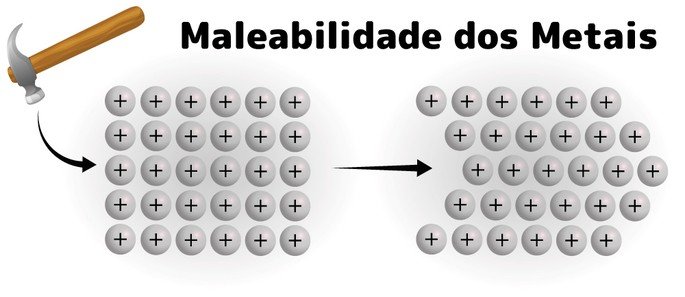
São considerados bons condutores elétricos e térmicos (calor), possuem densidade elevada, alto ponto de fusão e ebulição, maleabilidade e ductibilidade.
Teoria da nuvem eletrônica
Também denominada de “Teoria do Mar de Elétrons”, a Teoria da Nuvem eletrônica determina o fluxo de elétrons.
Nas ligações metálicas, ocorre a liberação de elétrons que formam cátions (íons de carga positiva), e são chamados de “elétrons livres”.
Em outras palavras, os elétrons mais externos, uma vez que estão mais distantes do núcleo do átomo, movimentam-se livremente formando uma “nuvem” ou um “mar” de elétrons
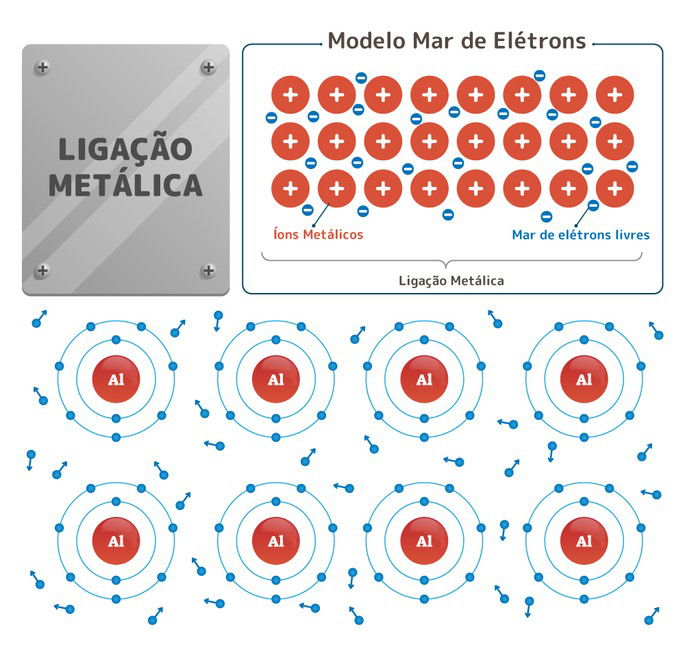
Esse modelo confere a propriedade de maleabilidade e ductibilidade dos metais. Esses elementos correspondem a um conglomerado de átomos neutros e cátions imersos numa nuvem ou “mar” de elétrons livres, formando, assim, as ligações metálicas. Estas, mantém os átomos unidos por meio de um retículo cristalino.
Exemplos de ligas metálicas
As ligas metálicas, constituídas por dois ou mais tipos de metais e formadas através das ligações metálicas, são utilizadas na confecção de muito produtos.
Merecem destaque os fios, lâmpadas, estruturas de carros, bicicletas, viadutos, eletrodomésticos, dentre outros.
A seguir, apresentamos alguns exemplos mais notórios das ligas metálicas:
- Aço Comum: liga metálica muito resistente composta de ferro (Fe) e carbono (C), utilizada nas construções de pontes, fogão, geladeira, dentre outras.
- Aço Inoxidável: composta de ferro (Fe), carbono (C), cromo (Cr) e níquel (Ni). Diferente do aço comum, essa liga metálica não sofre oxidação, ou seja, não enferruja, sendo utilizada na construção de vagões de metrô, trens, fabricações de peças automotivas, utensílios cirúrgicos, fogões, pias, talheres, etc.
- Bronze: liga metálica formada por cobre (Cu) e estanho (Sn) e utilizada na construção de estátuas, fabricação de sinos, moedas, etc.
- Latão: constituída de cobre (Cu) e zinco (Zn), esse tipo de liga metálica é muito utilizada na fabricação de armas, torneiras, etc.
- Ouro: n fabricação de joias, o ouro não é empregado em sua forma pura, ou seja, da forma encontrada na natureza. Assim, a liga metálica formada para a fabricação de joias é composta de 75% de ouro (Au) e 25% de cobre (Cu) ou prata (Ag). Observe que para a confecção de joias de ouro 18 quilates, utilizam-se 25% de cobre, enquanto o ouro chamado de 24 quilates é considerado “ouro puro”. Além disso, a liga metálica composta de ouro é utilizada na fabricação de veículos espaciais, acessórios de astronautas, dentre outros.
Curiosidade
A “Idade dos Metais”, última fase da pré-história, foi caracterizada pela descoberta e dominação dos metais pelos homens, seja na confecção de artefatos, armas ou ferramentas.
Posteriormente, expandiu-se o conhecimento sobre as técnicas de fundição e, a partir disso, os metais tornaram-se elementos essenciais na construção da humanidade.
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005.
MAGALHÃES, Lana. Ligações Metálicas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/ligacoes-metalicas/. Acesso em:



