Massa Atômica
A massa atômica é a forma padrão para medir a massa dos átomos, expressa em unidade de massa atômica (u).
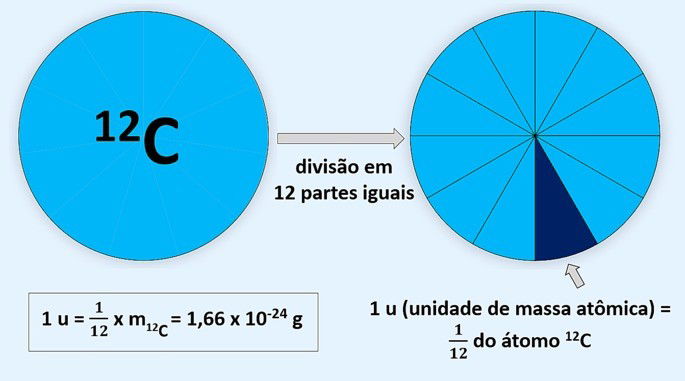
Os químicos resolveram tomar como base o carbono, por isso diz-se que a massa atômica é relativa. Foi determinado que uma unidade de massa atômica equivale a 1,66 x 10-24 g, o mesmo que 1/12 da massa do carbono-12.
As massas dos átomos são comparadas com esse padrão de 1u, o que quer dizer que a massa atômica indica quantas vezes um átomo pesa mais do que 1/12 do carbono.
Vejamos alguns exemplos de massa atômica:
- Carbono (C) - 12,011
- Oxigênio (O) - 15,999
- Cloro (Cl) - 35,453
- Nitrogênio (N) - 14,007
- Potássio (K) - 39,098
- Hélio (He) - 4,003
Como calcular a massa atômica?
Na natureza podemos encontrar elementos químicos com o mesmo número atômico, mas com massas atômicas diferentes. Estes elementos são chamados de isótopos.
A massa atômica dos elementos químicos resulta da média ponderada dos isótopos.
Tomemos como exemplo dois isótopos de um elemento químico qualquer: 22X e 36X, onde 22 e 36 são suas massas.
Vamos imaginar também que a abundância desses isótopos na natureza é de 40% e 60%, respectivamente.
A partir desses dados, é possível calcular a massa atômica. Primeiro, multiplica-se a massa pela abundância de cada um dos isótopos. Em seguida, soma-se esses resultados e divide-se por 100.

Portanto, a massa atômica de um elemento X, cujas massas dos isótopos são 22 e 36 e abundância de 40% e 60%, respectivamente, é de 30,4 u.
Massa Molecular e Massa Molar
A massa molecular corresponde a massa de uma molécula. Para calculá-la é necessário somar as massas atômicas dos átomos dos elementos químicos que compõem a substância.
Por exemplo, a água (H2O) é formada por 2 átomos de hidrogênio e 1 átomo de oxigênio. Para determinar a massa molecular da água, consultamos a tabela periódica para encontrar a massa atômica de cada elemento e multiplicamos pelo número de átomos.
H: 2 x 1 u = 2 u
O: 1 x 16 u = 16 u
H2O = 2 u + 16 u = 18 u
Portanto, uma molécula de água possui massa de 18 u.
A massa molar, por sua vez, é a massa expressa em gramas por mol. O mol é unidade utilizada como padrão para medir a quantidade de matéria. Essa unidade tem o valor absoluto de 6,02 x 1023 átomos, íons ou moléculas de uma substância.
A massa molecular e a massa molar tem o mesmo valor numérico, mas são apresentadas em unidades diferentes. Sendo assim, a molécula de água tem massa molecular de 18 u e massa molar de 18 g/mol.
Saiba mais em Número de Mol e Massa Molar.
Massa atômica na Tabela Periódica
Como a massa atômica depende da massa de todos os isótopos de um elemento químico, para evitar que sejam sempre feitos os cálculos, a tabela periódica apresenta essa informação.
Veja o exemplo do ferro:

A massa atômica é o valor que aparece logo abaixo dos nomes de cada elemento na tabela periódica.
A tabela periódica está organizada por ordem crescente de número atômico. Geralmente, a massa atômica aumenta conforme o aumento do número atômico. Dos 118 elementos químicos da tabela periódica apenas 4 elementos consecutivos diferem dessa generalidade. São eles: argônio, cobalto, telúrio e tório.
Exercícios sobre massa atômica
Questão 1
(UFPE) Existem dois isótopos do rubídio que ocorrem na natureza: 85Rb, que tem massa igual a 84,91, e 87Rb, cuja massa é 86,92. O peso atômico do rubídio é 85,47. Qual é a porcentagem do 87Rb?
a) 72,1%
b) 20,1%
c) 56,0%
d) 27,9%
e) 86,9%
Questão 2
(Cesgranrio-RJ) Um elemento X tem massa atômica 63,5 e apresenta os isótopos 63X e 65X. A abundância do isótopo 63 no elemento X é:
a) 25%
b) 63%
c) 65%
d) 75%
e) 80%
Observação: Considere os números de massa 63 e 65 como sendo as massas atômicas desses isótopos.
Questão 3
(UFRGS_RS) O elemento cloro apresenta massa atômica igual a 35,453 u. Esta informação significa que:
a) o átomo de cloro apresenta massa 35,453 vezes maior que a massa do átomo de hidrogênio.
b) a massa de um átomo de cloro é 35,453 vezes maior que a massa do isótopo 12 do carbono.
c) a relação entre as massas dos átomos de cloro e de carbono é 35,453 ÷ 12.
d) qualquer átomo de cloro apresenta massa 35,453 vezes maior que 1/12 do isótopo 12 do carbono.
e) a média ponderada das massas dos isótopos do cloro é 35,453 vezes maior que 1/12 da massa do isótopo 12 do carbono.
Questão 4
(FEI-SP) Se um átomo apresentar a massa atômica igual a 60 u, a relação entre a massa desse átomo e a massa do átomo de carbono 12 valerá?
a) 1
b) 2
c) 3
d) 4
e) 5
Questão 5
(UFSCar-SP) O elemento magnésio, número atômico 12, ocorre na natureza como uma mistura de três isótopos. As massas atômicas destes isótopos, expressas em unidades de massa atômica (u), e suas respectivas abundâncias num dado lote do elemento, são fornecidas na tabela a seguir.
| Número de massa do isótopo | Massa atômica (u) | % abundância |
|---|---|---|
| 24 | 23,98504 | 10 |
| 25 | 24,98584 | 10 |
| 26 | 25,98259 | 80 |
A massa atômica deste lote, em u, é igual a:
a) 23,98504, exatamente.
b) 24,98584, exatamente.
c) 25,98259, exatamente.
d) um valor compreendido entre 23,98504 e 24,98584.
e) um valor compreendido entre 24,98584 e 25,98259.
Para praticar: Exercício sobre massa atômica (com gabarito explicado)
Confira também questões de vestibulares com resolução comentada em Exercícios sobre a Tabela Periódica.
BATISTA, Carolina. Massa Atômica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/massa-atomica/. Acesso em:


