Modelo Atômico de Bohr
O Modelo Atômico de Bohr mostra o átomo como um sistema em que os elétrons giram ao redor de um núcleo central, seguindo órbitas específicas. É como se o núcleo fosse o "coração" do átomo, e os elétrons fossem partículas que circulam ao seu redor em caminhos definidos.
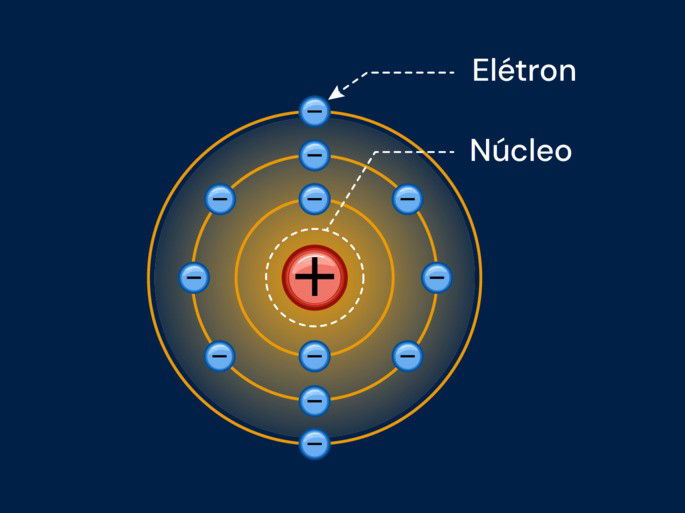
Esse modelo foi criado pelo físico dinamarquês Niels Bohr (1885-1962), que aprimorou a teoria atômica proposta por Rutherford. Bohr resolveu um problema que existia na teoria anterior, explicando melhor como os elétrons se comportam no átomo.
O modelo atômico de Rutherford – Bohr
Niels havia conhecido Rutherford no laboratório da Universidade de Cambridge e foi levado por ele à Universidade de Manchester onde passaram a trabalhar em conjunto.
Bohr conseguiu explicar como se comportava o átomo de hidrogênio, o que não era possível mediante a teoria atômica de Rutherford.
Mas, embora tenha aperfeiçoado o modelo atômico de Rutherford, o modelo de Bohr ainda não é perfeito, uma vez que continuam havendo lacunas por explicar.
Em 1913, Bohr promoveu experimentos que mostravam essas falhas e propunha um novo modelo. Inspirado nas ideias de Planck sobre a quantização da energia, Bohr postulou que os elétrons só podem ocupar órbitas específicas ao redor do núcleo, com energias quantizadas, ou seja, valores específicos de energia. Essas órbitas são chamadas de "estados estacionários" e não emitem radiação.
Se o modelo proposto de Rutherford estivesse correto, ao serem acelerados, os elétrons emitiriam ondas eletromagnéticas. Na sequência, essas partículas perderiam energia e consequentemente colidiriam com o núcleo atômico.
O que acontece, na verdade, é que o elétron emite energia. Quanto maior a sua energia, mais afastado ele fica do núcleo do átomo.
Como surgiu o modelo de Rutherford
Em 1911, o físico Ernest Rutherford propôs um novo modelo para o átomo, baseado em experimentos que ele realizou. Rutherford descobriu que o átomo é composto por um núcleo pequeno e denso, com carga positiva, e por elétrons que orbitam ao redor desse núcleo, como planetas ao redor do Sol. Essa foi uma grande descoberta, mas o modelo de Rutherford tinha um problema: ele não conseguia explicar por que os elétrons não caíam no núcleo.
O modelo de Rutherford representou um grande avanço no entendimento da estrutura atômica com a introdução do conceito de espaço vazio e de regiões em um átomo. De acordo com o modelo de Rutherford, o elétron no átomo de hidrogênio poderia ter qualquer energia, a qual seria determinada por sua distância do núcleo.
Saiba mais sobre os modelos atômicos e a evolução dos modelos atômicos.
Postulados de Bohr
Mediante o trabalho que desenvolveu, Bohr obteve quatro princípios:
- Quantização da energia atômica: cada elétron apresenta uma quantidade específica de energia. Ou seja, a energia dos elétrons não é contínua, mas sim quantizada, o que significa que ela só pode assumir valores específicos. Para facilitar a compreensão, compare com degraus de uma escada, onde só se pode estar em um degrau ou outro, não entre eles.
- Estados estacionários: os elétrons se movem em órbitas específicas, chamadas de "estados estacionários". Ao absorver energia, o elétron salta para uma órbita mais distante do núcleo.
- Transições eletrônicas: quando um elétron absorve energia, o nível de energia do elétron aumenta, saltando para uma camada mais externa. Por outro lado, ela diminui quando o elétron emite energia.
- Camadas eletrônicas: os níveis de energia, ou camadas eletrônicas, acomodam um número determinado de elétrons e são designados pelas letras: K, L, M, N, O, P, Q.
Sua principal contribuição foi em relação ao movimento dos elétrons nos átomos. Os elétrons dos átomos, ao absorverem energia suficiente, são excitados para órbitas mais externas. Ao retornarem para o estado fundamental, liberam essa energia na forma de luz, com comprimento de onda (λ) que compreende as faixas de energia do espectro eletromagnético, dentre elas a faixa do visível.
Uma das consequências das transições eletrônicas descritas pelo modelo de Böhr é a possibilidade de visualização das diferentes cores observadas, por exemplo, nos fogos de artifício.
Já as transições eletrônicas envolvendo moléculas, que ocorrem entre os orbitais moleculares, resultam nas diferentes cores observadas nas frutas, nos corantes, nas pulseiras de festas que brilham, entre outros.
O modelo de Bohr estava ligado à Mecânica Quântica. Assim, a partir da década de 20, Erwin Schrödinger, Louis de Broglie e Werner Heisenberg, especialmente, dão o seu contributo no que respeita ao modelo da estrutura atômica.
Limitações do Modelo de Bohr
O modelo de Bohr foi um avanço significativo na nossa compreensão da estrutura atômica, mas ele tinha algumas limitações importantes. Vamos dar uma olhada em cada uma delas:
1. Só funciona para átomos com um único elétron
O modelo de Bohr explica muito bem o comportamento do átomo de hidrogênio, que tem apenas um elétron. No entanto, ele não consegue explicar o espectro de átomos com múltiplos elétrons. Isso acontece porque, nesses átomos, as interações entre os elétrons se tornam muito complexas para serem descritas pelo modelo de Bohr.
2. Não explica a intensidade das linhas espectrais
Quando um átomo emite luz, essa luz é composta por diferentes cores, que aparecem como linhas em um espectro. O modelo de Bohr consegue prever as cores dessas linhas, mas não consegue explicar por que algumas linhas são mais brilhantes (mais intensas) do que outras.
3. Ignora a dualidade onda-partícula do elétron
O modelo de Bohr trata os elétrons como partículas. No entanto, os elétrons também se comportam como ondas, como a luz. O modelo de Bohr ignora essa natureza ondulatória dos elétrons, o que é uma simplificação excessiva.
4. Não explica as ligações químicas
O modelo de Bohr não consegue explicar como os átomos se ligam para formar moléculas. As ligações químicas são baseadas nas interações entre os elétrons dos átomos, e o modelo de Bohr, com sua descrição simplificada dos elétrons, não é suficiente para explicar essas interações.
Para superar essas limitações, os cientistas desenvolveram um modelo mais completo e preciso, chamado de modelo da mecânica quântica.
Esse modelo leva em conta a natureza ondulatória dos elétrons e descreve os elétrons não como bolinhas em órbitas, mas como nuvens de probabilidade ao redor do núcleo. O modelo da mecânica quântica é mais complexo, mas é capaz de explicar o comportamento de átomos de qualquer tipo, incluindo suas interações e ligações.
Exercícios
Questão 1
1. Por que um átomo excitado emite energia, muitas vezes em forma de luz visível?
a) um de seus elétrons foi arrancado do átomo
b) um dos elétrons desloca-se para níveis de energia mais baixos, aproximando-se do núcleo.
c) um dos elétrons desloca-se para níveis de energia mais altos, afastando-se do núcleo.
d) os elétrons permanecem estacionários em seus níveis de energia
Correta: b) um dos elétrons desloca-se para níveis de energia mais baixos, aproximando-se do núcleo.
Um átomo é considerado excitado quando um ou mais de seus elétrons absorvem energia, seja por calor, luz ou eletricidade, e saltam para níveis de energia mais altos, mais distantes do núcleo. Quando um elétron retorna ao seu nível (ou a um nível mais baixo), ele libera a energia absorvida em forma de um fóton de luz.
Incorretas:
a) Um de seus elétrons foi arrancado do átomo: A remoção de um elétron de um átomo é chamada de ionização, e não necessariamente leva à emissão de luz visível.
c) Um dos elétrons desloca-se para níveis de energia mais altos, afastando-se do núcleo. Quando um elétron se move para um nível de energia mais alto, ele absorve energia, não a emite.
d) Os elétrons permanecem estacionários em seus níveis de energia. Os elétrons não permanecem estacionários. Caso permanecessem, não haveria transições eletrônicas e não haveria emissão de luz.
Questão 2
Para praticar mais:
- Exercícios sobre Modelo Atômico de Bohr (com respostas explicadas)
- Exercício sobre modelos atômicos (com respostas explicadas)
- Exercícios sobre física quântica (com explicações)
Quer conhecer os outros modelos atômicos? Leia:
- Modelo Atômico de Dalton, o qual tem o aspecto de uma bola de bilhar
- Modelo Atômico de Thomson, também conhecido como “modelo pudim de ameixa” ou “pudim com passas” em decorrência do seu aspecto
- Modelo Atômico de Rutherford, o qual apresenta o aspecto de um sistema planetário.
- Modelo atômico de Schrödinger: o que é e as características da teoria
Referências Bibliográficas
ATKINS, Peter; JONES, Loretta. Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. 5. ed. Porto Alegre: Bookman, 1 2011.
BROWN, Theodore L.; LEMAY, H. Eugene; BURSTEN, Bruce E. Química: A Ciência Central. 10. ed. São Paulo: Pearson, 2016.
Modelo de Bohr. NUPIC - Núcleo de Pesquisa Interdisciplinar em Cultura e Infância, 2016. Acesso em: 21 de fevereiro de 2025.
A12 - Modelo Atômico de Bohr. QNESC - Química Nova na Escola, v. 19, 2004.
Modelo Atômico de Bohr: uma abordagem histórica e suas implicações para o ensino de química. Ciênc. educ. (Bauru), v. 18, n. 3, p. 681-698, 2012. Disponível em: https://www.scielo.br/j/ciedu/a/gJsCwzN8yCbWvhrJpKSHMKg/?format=pdf&lang=pt.Acesso em: 21 de fevereiro de 2025.
CAMPOS, Adriana. Modelo Atômico de Bohr. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/modelo-atomico-de-bohr/. Acesso em:


