Modelo Atômico de Rutherford
O Modelo Atômico de Rutherford sugere que o átomo apresenta o aspecto de um sistema planetário. Por esse motivo ele é chamado de modelo planetário ou de modelo de átomo nucleado.
De acordo com esse modelo apresentado em 1911, os elétrons giram em torno do núcleo (formado por prótons e nêutrons), de forma semelhante aos planetas que giram à volta do Sol.
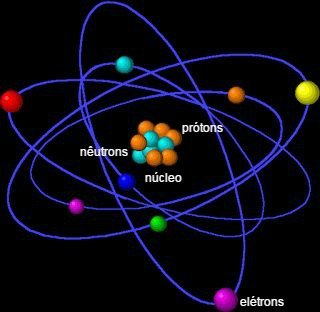 Modelo Atômico de Rutherford
Modelo Atômico de Rutherford
Este modelo substituiu aquele que havia sido proposto por Thomson em 1903. Antes desse, porém, já haviam surgido outros modelos atômicos acerca da distribuição das partículas atômicas.
O modelo de Rutherford representa uma revolução nessa matéria e tornou-se a base da teoria atômica.
O Experimento de Rutherford
Em 1910, Rutherford (1871-1937) estava estudando a trajetória de partículas e a interação entre a radiação alfa e os materiais. Nessa ocasião, ele detectou que havia uma limitação no modelo atômico apresentado por Thomson, o Modelo Atômico de Thomson.
Rutherford fez uma câmera metálica fechada e nela colocou um pequeno recipiente de chumbo com fragmentos de polônio.
Na frente desse recipiente que tinha uma abertura, ele posicionou uma lâmina de ouro bastante fina coberta por uma película de sulfeto de zinco.
Tudo isso estava conectado a um microscópio que era capaz de girar 360º em torno da lâmina de ouro. O objetivo era analisar a incidência das partículas que penetravam através da folha e desintegravam-se espontaneamente de elementos radioativos naturais.
Era possível ver cada incidência de partículas sob a película de sulfeto de zinco através de um ponto destacado no microscópio.
Rutherford anotou a incidência de partículas nos mais diversos ângulos de forma que pudesse analisar cuidadosamente o seu comportamento.
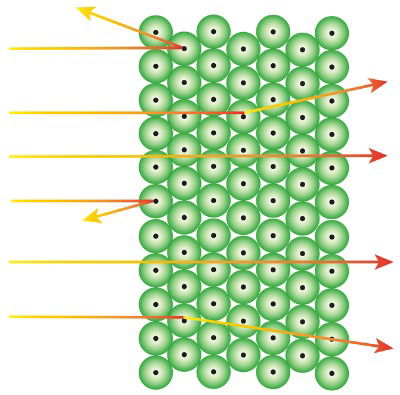 Redirecionamento da radiação alfa no experimento de Rutherford
Redirecionamento da radiação alfa no experimento de Rutherford
A partir da sua análise, Rutherford verificou que o comportamento das partículas era padronizado. A maior parte delas conseguia atravessar a folha (embora com alguma dificuldade), outras ficavam bloqueadas, enquanto havia ainda algumas que nem sequer eram afetadas.
Rutherford concluiu que haviam muitos espaços vazios e que o centro do átomo era muito menor considerando todo o seu diâmetro. Assim, ele descobriu a eletrosfera. Ou seja, o átomo era formado por um núcleo, onde havia carga positiva concentrada, e por uma eletrosfera, onde se concentra a carga negativa.
Rutherford não sabia do que era constituído o núcleo. Ele apenas supunha que existissem nêutrons, mas isso só foi comprovado na década de 30.
Os elétrons, por sua vez, já descobertos por Thomson em 1905, localizam-se na eletrosfera e circulam ao redor desse pequeno sol nuclear.
Conheça a evolução dos modelos atômicos.
Falha no Modelo de Rutherford
Apesar dos avanços, o modelo apresentava erro, o qual é apontado através da teoria do eletromagnetismo.
As partículas com carga elétrica emitem uma onda eletromagnética quando são aceleradas. Seguindo o modelo de Rutherford é o que aconteceria com o elétron que, neste caso, perderia energia e cairia sobre o núcleo, mas não é o que acontece.
O modelo atômico continuou em evolução e Niels Bohr completou a lacuna que havia no modelo de Rutherford. Por esse motivo, esse modelo é chamado de Modelo Atômico de Rutherford-Bohr.
Expanda os seus estudos também sobre o Modelo atômico de Schrödinger: o que é e as características da teoria.
Teste seus conhecimentos sobre o tema em:
- Exercício sobre modelo atômico de Rutherford (com gabarito)
- Exercício sobre modelos atômicos (com respostas explicadas)
MAGALHÃES, Lana. Modelo Atômico de Rutherford. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/modelo-atomico-de-rutherford/. Acesso em:


