Ponto de Fusão e Ebulição
O ponto de fusão e o ponto de ebulição representam a temperatura que uma substância muda de estado, em uma dada pressão.
No caso do ponto de fusão, a substância muda do estado sólido para o estado líquido. Já o ponto de ebulição refere-se a mudança do estado líquido para o estado gasoso.
Por exemplo, o gelo começa a se transformar em água na forma líquida, quando sua temperatura é igual a 0 ºC . Logo, o ponto de fusão da água é 0 ºC (sob pressão de 1 atmosfera).
Para passar de líquida para vapor, a água deve atingir a temperatura de 100 ºC. Assim, o ponto de ebulição da água é 100 ºC (sob pressão de 1 atmosfera).

Ponto de Fusão
Quando uma substância no estado sólido recebe calor, ocorre um aumento no grau de agitação de suas moléculas. Consequentemente sua temperatura também aumenta.
Ao atingir uma determinada temperatura (ponto de fusão), a agitação das moléculas é tal que rompe as ligações internas entre os átomos e moléculas.
Nesse ponto, a substância começa a mudar seu estado e passará para o estado líquido se continuar recebendo calor.
Durante a fusão sua temperatura se mantém constante, pois o calor recebido é usado unicamente para a mudança de estado.

O calor por unidade de massa necessário para mudar de fase é chamado de calor latente de fusão (Lf) e é uma característica da substância.
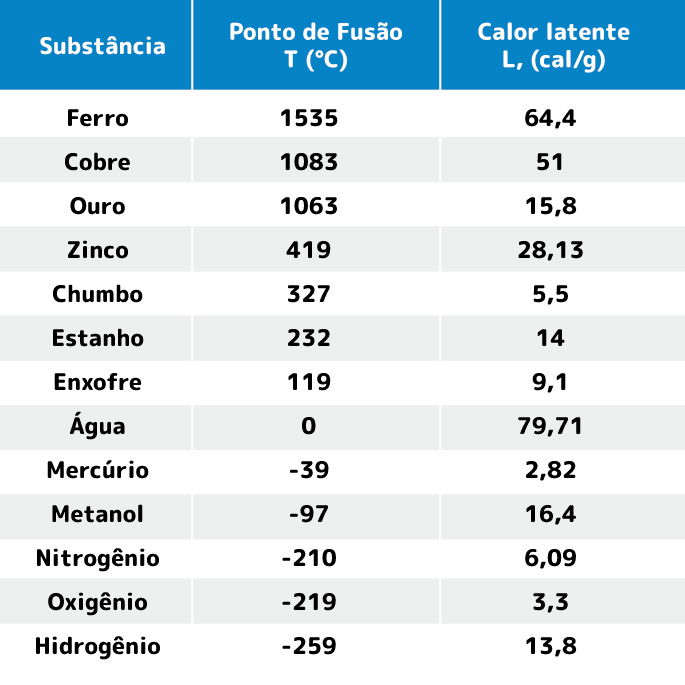
Tabela do ponto de fusão e calor latente
Na tabela abaixo indicamos a temperatura do ponto de fusão e o calor latente de algumas substâncias à pressão atmosférica.
Ponto de Ebulição
A ebulição é caracterizada pela passagem rápida do estado líquido para o gasoso, com a formação de vapores (bolhas) no interior do líquido.
Da mesma forma que ocorre na fusão, existe uma temperatura (ponto de ebulição) em que uma determinada substância passa do estado líquido para o estado gasoso.
Para que isso ocorra é necessário que a substância receba calor. Durante toda a mudança de fase, a temperatura permanece constante.
O calor latente de vaporização (Lv) é a quantidade de calor por unidade de massa, necessária para uma substância mudar de fase.
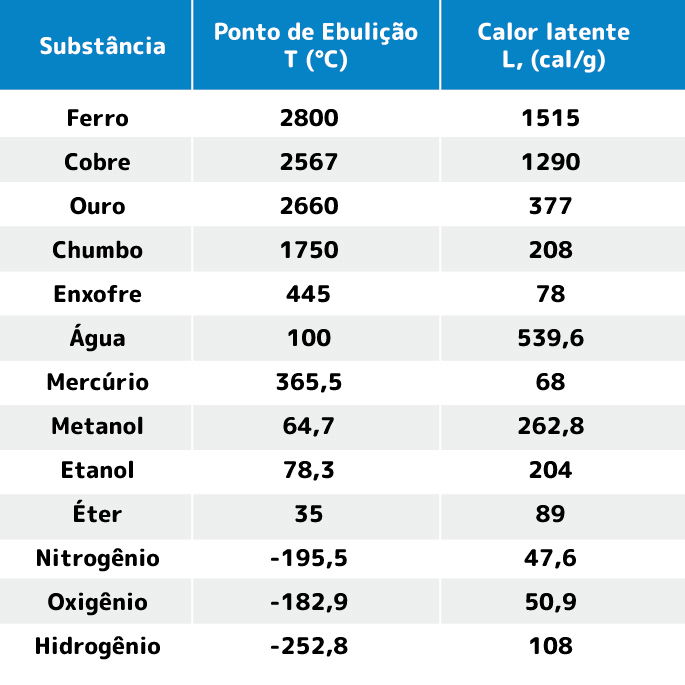
Tabela do ponto de ebulição e calor latente
Na tabela abaixo, indicamos a temperatura do ponto de ebulição e o calor latente de vaporização de algumas substâncias à pressão atmosférica.
Interferência da pressão
A temperatura do ponto de fusão e do ponto de ebulição depende da pressão exercida sobre a substância.
De uma maneira geral, as substâncias aumentam de volume quando sofrem fusão. Este fato faz com que quanto maior a pressão, maior deverá ser a temperatura para que a substância mude de fase.
A exceção ocorre com algumas substâncias, entre elas a água, que diminui seu volume quando sofrem fusão. Neste caso, uma maior pressão irá diminuir o ponto de fusão.

Uma diminuição na pressão faz com que o ponto de ebulição de uma determinada substância seja menor, ou seja, a substância irá ferver em uma menor temperatura.
Por exemplo, em lugares acima do nível do mar a água ferve com temperaturas menores que 100 ºC. Com isso, nesses lugares demora-se muito mais para cozinhar do que em lugares ao nível do mar.
Leia também:
- Mudanças de Estado Físico
- Escalas Termométricas
- Escalas Termométricas - Exercícios
- Estados Físicos da Água
- Diagrama de Fases
- Solidificação
- Condensação
- Propriedades Coligativas
- Propriedades Periódicas
- Evaporação
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005, 671p.
GOUVEIA, Rosimar. Ponto de Fusão e Ebulição. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/ponto-de-fusao-e-ponto-de-ebulicao/. Acesso em:



