Solidificação
A solidificação é a mudança do estado líquido para o estado sólido. Para que ocorra a solidificação é necessário que, estando submetido a uma dada pressão, o corpo perca calor até atingir uma determinada temperatura.
A quantidade de calor necessária para um corpo se solidificar depende da substância que o constitui.
No estado líquido, os átomos das substâncias estão mais afastados uns dos outros. Apresentam um grau de vibração e temperatura maior do que no estado sólido.
Ao ceder calor, ocorre uma redução da vibração dos átomos e a distância entre eles torna-se menor. Esta redução provoca um aumento das forças internas.
Se continuar perdendo calor e sua temperatura atingir um determinado valor chamado de ponto de solidificação, o corpo irá se solidificar.
No estado sólido a substância apresenta maior organização entre seus átomos, estruturados numa rede cristalina. Continuam apresentando movimento de vibração, contudo este ocorre em torno de um ponto médio.

Características da Solidificação
As mudanças de estado acontecem seguindo um determinado padrão. Verifica-se experimentalmente que o processo de solidificação apresenta as seguintes características:
-
Mantendo-se constante a pressão, a temperatura durante todo o processo de solidificação permanece constante.
-
A quantidade de calor por unidade de massa é chamado de calor latente de solidificação e é uma característica da substância.
-
A temperatura em que cada substância sofre solidificação é bem determinada, e é chamada de ponto de solidificação.
Ponto de Solidificação
O ponto de solidificação é a temperatura em que a substância deve atingir para iniciar o processo de solidificação. Essa temperatura é a mesma para a substância sofrer fusão (ponto de fusão).
Os pontos de solidificação das substâncias são determinados experimentalmente. Essa temperatura depende do valor da pressão que a mesma está submetida.
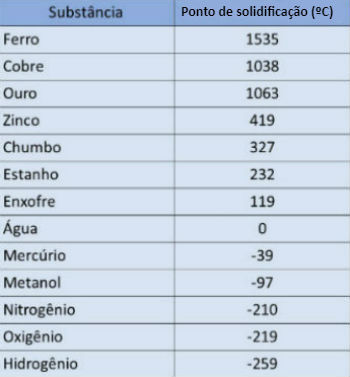
Na tabela abaixo, apresentamos o ponto de solidificação para algumas substâncias sob pressão de 1 atmosfera:
Quantidade de Calor Latente
Conhecendo a massa de um corpo, podemos calcular a quantidade de calor que será necessária perder para que o corpo se solidifique. Para tal, devemos conhecer o valor do calor latente de solidificação da substância que o compõe.
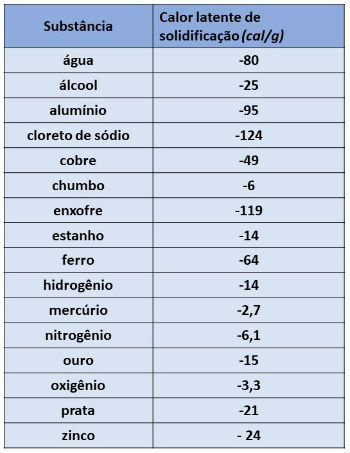
Abaixo, apresentamos o valor do calor latente de solidificação de algumas substâncias:
Fórmula
Para calcular a quantidade de calor necessária para um corpo mudar de fase usamos a seguinte fórmula:
Sendo,
Q: quantidade de calor latente (cal)
m: massa (g)
Ls: calor latente de solidificação (cal/g)
Exemplo
Calcule a quantidade de calor que 300 g de água a 0 ºC deverá perder para se transformar totalmente em gelo a 0 ºC.
O valor do calor latente de solidificação da água é igual a - 80 cal/g. Substituindo na fórmula, temos:
Q = 300 . (- 80) = - 24 000 cal
O sinal de menos indica que a água deverá perder 24 000 cal para se tornar gelo.
Anomalia da água
As substâncias, de uma maneira geral, diminuem seu volume ao se solidificarem. A água é uma exceção, ou seja, ao se transformar em gelo ela aumenta de volume.
Este fato pode ser comprovado quando colocamos uma garrafa totalmente cheia de água no congelador. Ao congelar, a água aumentará de volume e quebrará a garrafa.
Saiba mais sobre o assunto lendo: Ciclo da Água e Estados Físicos da Água.
Mudanças de Fase
Além da solidificação, exitem ainda outros processos de mudança de estado. São eles:
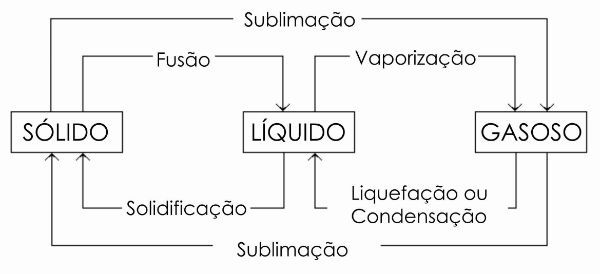
No diagrama abaixo, representamos os três estados físicos da matéria e as respectivas mudanças de fase.
Para saber mais, leia também sobre:
GOUVEIA, Rosimar. Solidificação. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/solidificacao/. Acesso em:


