Classificação periódica dos elementos
A classificação periódica dos elementos corresponde à organização dos elementos químicos em ordem crescente de número atômico na Tabela Periódica. Esta ordenação segue a Lei da Periodicidade proposta em 1913 por Henry Monseley (1887-1915).
O físico inglês identificou que de acordo com o número de prótons no núcleo do átomo de um elemento químico, ou seja, seu número atômico (Z), a variação de muitas propriedades ocorre em intervalos regulares.
Os 118 elementos químicos conhecidos estão dispostos em grupos e períodos. De acordo com as propriedades físicas e químicas, é possível fazer a divisão entre metais, não metais (ametais) e semimetais (metaloides) na Tabela Periódica.
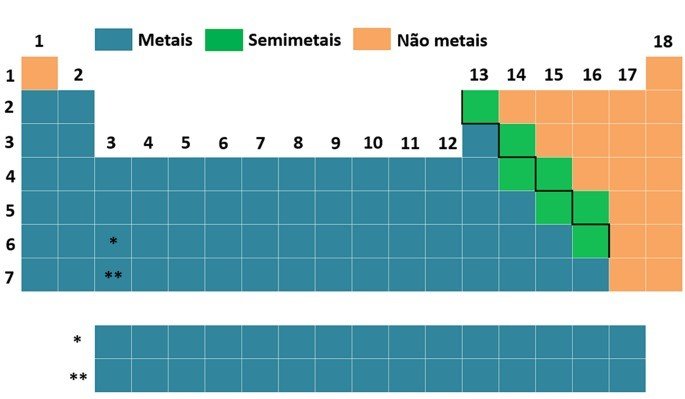
As linhas verticais são os 18 grupos da tabela e reúnem os elementos com propriedades químicas semelhantes. As linhas horizontais correspondem aos 7 períodos e apresentam os elementos com mesmo número de camadas eletrônicas.
O hidrogênio é um elemento que está posicionado acima do grupo 1 por causa da sua distribuição eletrônica, mas não apresenta características em comum com a família de metais.
Confira a Tabela Periódica completa e atualizada.
Metais
A maior parte dos elementos químicos da Tabela Periódica são classificados como metais. As principais características dos metais são:
- Apresentam brilho característico;
- São densos, maleáveis e dúcteis;
- São bons condutores de eletricidade e calor;
- Apresentam-se em condições ambientes no estado sólido, com exceção do mercúrio.
Os elementos metálicos da Tabela Periódica são:
Metais alcalinos (grupo1): lítio, sódio, potássio, rubídio, césio e frâncio.
Metais alcalinoterrosos (grupo 2): berílio, magnésio, cálcio, estrôncio, bário e rádio.
Metais representativos, além dos elementos dos grupos 1 e 2: alumínio, gálio, índio, tálio, niônio, estanho, chumbo, fleróvio, bismuto, moscóvio e livermório.
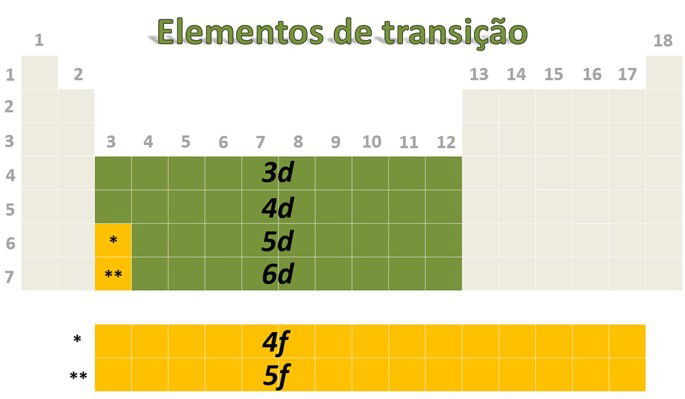
Metais de transição externa são os elementos que ocupam a parte central da Tabela Periódica:
- Grupo 3: escândio e ítrio.
- Grupo 4: titânio, zircônio, háfnio e rutherfórdio.
- Grupo 5: vanádio, nióbio, tântalo e dúbnio.
- Grupo 6: cromo, molibdênio, tungstênio e seabórgio.
- Grupo 7: manganês, tecnécio, rênio e bóhrio.
- Grupo 8: ferro, rutênio, ósmio e hássio.
- Grupo 9: cobalto, ródio, irídio e meitnério.
- Grupo 10: níquel, paládio, platina, darmstádio.
- Grupo 11: cobre, prata, ouro e roentgênio.
- Grupo 12: zinco, cádmio, mercúrio e copernício.
Metais de transição interna são os elementos que fazem parte do grupo 3 e correspondem às séries dos lantanídeos e actinídeos.
A série de lantanídeos é formada por lantânio, cério, praseodímio, neodímio, promécio, samário, európio, gadolínio, térbio, disprósio, hólmio, érbio, túlio, itérbio e lutécio.
A série de actinídeos contém os elementos actínio, tório, protactínio, urânio, netúnio, plutônio, amerício, cúrio, berquélio, califórnio, einstéinio, férmio, mendelévio, nobélio e laurêncio.
Leia mais sobre os metais alcalinos.
Não metais
Os não metais estão localizados na parte direita da Tabela Periódica, com exceção do hidrogênio, e apresentam características opostas aos metais, por exemplo:
- Não apresentam aspecto brilhoso;
- Não são maleáveis e dúcteis;
- Não são bons condutores de eletricidade e calor, por isso são usados como isolantes;
- Apresentam baixos pontos de ebulição e fusão, sendo normalmente encontrados na natureza no estado gasoso e líquido.
Os elementos não metálicos são: hidrogênio, nitrogênio, oxigênio, carbono, fósforo, selênio, enxofre, halogênios e gases nobres.
Os halogênios são os elementos que pertencem ao grupo 17: flúor, cloro, bromo, iodo, astato e tenessino.
Os gases nobres são os elementos que pertencem ao grupo 18: hélio, neônio, argônio, criptônio, xenônio, radônio, oganessônio.
Saiba mais sobre os gases nobres e os halogênios.
Semimetais
Os semimetais apresentam propriedades intermediárias entre metais e ametais. Embora suas propriedades físicas sejam mais próximas dos não metais, quando são expostos a algumas circunstâncias esses materiais se tornam semicondutores.
Os elementos semimetais ou metaloides são: boro, silício, germânio, arsênio, antimônio, telúrio e polônio.
Leia também sobre as famílias da tabela periódica.
Elementos representativos e de transição
Outra forma de classificar os elementos é dividindo-os em elementos representativos e de transição conforme a distribuição eletrônica do átomo.
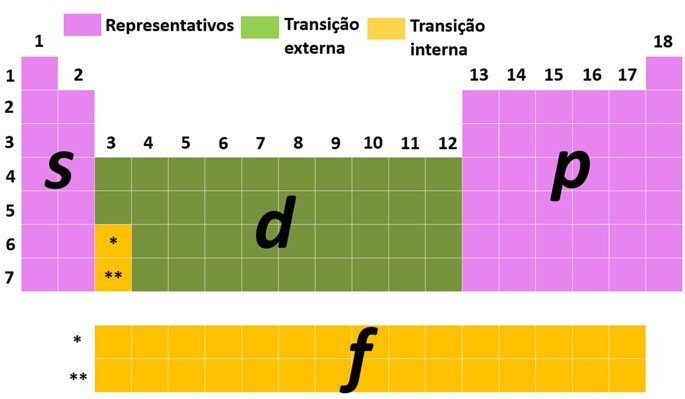
Os elementos representativos são aqueles que apresentam a configuração eletrônica terminada com o subnível mais energético em s (grupos 1 e 2) ou p (grupos 13, 14, 15, 16, 17 e 18).

Os elementos de transição são divididos em transição externa e interna. Na transição externa os elementos apresentam o elétron mais energético no subnível d e nos de transição interna o elétron mais energético está em um subnível f.
Exercícios sobre classificação dos elementos
Questão 1
Os elementos rubídio, neônio e silício são classificados respectivamente como:
a) metaloide, semimetal e não metal
b) metal, ametal e semimetal
c) semimetal, não metal e metaloide
d) ametal, metaloide e semimetal
Questão 2
Assinale a alternativa que apresenta apenas ametais da Tabela Periódica.
a) Ca, F, I e Hg
b) Cl, He, C e O
c) K, Ar, H e Pb
d) Mg, Kr, S e P
Questão 3
Segundo a distribuição eletrônica do átomo, os elementos da Tabela Periódica são classificados em
a) Elementos de transição e metaloides
b) Elementos representativos e de transição
c) Metais e ametais
d) Halogênios e calcogênios
Adquira mais conhecimento com os conteúdos:
- Propriedades periódicas
- Exercícios sobre Tabela Periódica
- Exercícios sobre Organização da Tabela Periódica
Vídeo sobre a Tabela Periódica
BATISTA, Carolina. Classificação periódica dos elementos. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/classificacao-periodica-dos-elementos/. Acesso em:


