Distribuição Eletrônica
A distribuição eletrônica ou configuração eletrônica a forma como os elementos químicos são ordenados considerando o número de elétrons que eles possuem e a sua proximidade do núcleo atômico.
Distribuição eletrônica em camadas
Após terem surgido vários modelos atômicos, o modelo de Bohr sugeriu a organização da eletrosfera em órbitas.
Os elétrons se organizam e distribuem-se pelas camadas eletrônicas, estando uns mais próximos do núcleo e outros mais distantes.
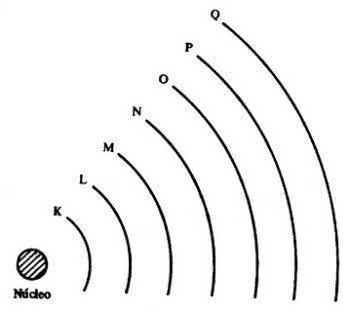
Então, surgiram as 7 camadas eletrônicas (K, L, M, N, O, P e Q), as quais são representadas pelas linhas horizontais numeradas de 1 a 7 na tabela periódica.
Os elementos que constam nas mesmas linhas apresentam o mesmo número máximo de elétrons e também os mesmos níveis de energia.
Com isso, é possível observar que os elétrons encontram-se em níveis e sub-níveis de energia. Assim, cada um possui uma determinada quantidade de energia.
|
Nível de Energia |
Camada Eletrônica |
Nº Máximo de Elétrons |
|---|---|---|
| 1° | K | 2 |
| 2° | L | 8 |
| 3° | M | 18 |
| 4° | N | 32 |
| 5° | O | 32 |
| 6° | P | 18 |
| 7° | Q | 8 |
A camada de valência é a última camada eletrônica, ou seja, a camada mais externa do átomo. Segundo a Regra do Octeto, os átomos possuem a tendência de se estabilizarem e ficarem neutros.
Isso acontece quando eles apresentam a mesma quantidade de prótons e nêutrons, com oito elétrons na última camada eletrônica.
Posteriormente, surgiram os subníveis de energia, representados pelas letras minúsculas s, p, d, f. Cada subnível suporta um número máximo de elétrons:
| Subníveis | Número máximo de elétrons |
|---|---|
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
Diagrama de Pauling
O químico estadunidense Linus Carl Pauling (1901-1994) estudou as estruturas atômicas e elaborou um esquema até hoje utilizado.
Pauling descobriu uma forma de colocar todos os subníveis de energia em ordem crescente, usando para tanto o sentido diagonal. O esquema ficou conhecido como o Diagrama de Pauling.
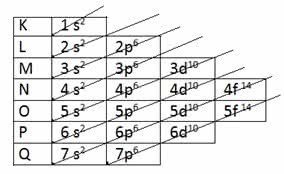
Ordem crescente: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Observe que o número indicado à frente do subnível de energia corresponde ao nível de energia.
Por exemplo, em 1s2:
- s indica o subnível energético
- 1 indica o primeiro nível, localizado na camada K
- expoente 2 indica o número de elétrons existentes nesse subnível
Como fazer a distribuição eletrônica?
Para entender melhor o processo de distribuição eletrônica, observe abaixo o exercício resolvido.
1. Faça a distribuição eletrônica do elemento Ferro (Fe) que apresenta número atômico 26 (Z = 26):
Ao aplicar o Diagrama de Linus Pauling, percorre-se as diagonais no sentido indicado no modelo. Preenche-se os subníveis de energia com os números máximos de elétrons por camada eletrônica, até completar os 26 elétrons do elemento.
Para fazer a distribuição, esteja atento ao número total de elétrons em cada subnível e nas respectivas camadas eletrônicas:
K - s2
L - 2s2 2p6
M - 3s2 3p6 3d10
N - 4s2
Observe que não foi necessário fazer a distribuição eletrônica em todas as camadas, visto que o número atômico do Ferro é 26.
Assim, a distribuição eletrônica desse elemento é representada da seguinte maneira: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. A soma dos números expoentes totalizam 26, ou seja, o número total de elétrons presentes no átomo de Ferro.
Se a distribuição eletrônica for indicada por camadas representa-se da seguinte maneira: K = 2; L = 8; M = 14; N = 2.
Aproveite para testar os seus conhecimentos em Exercícios sobre Distribuição Eletrônica.
Na tabela periódica, isso é mostrado da seguinte forma:

Leia também:
- Afinidade Eletrônica
- Números Quânticos
- Exercícios sobre a Tabela Periódica
- Exercícios sobre Estrutura Atômica
- Exercícios sobre Organização da Tabela Periódica
MAGALHÃES, Lana. Distribuição Eletrônica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/distribuicao-eletronica/. Acesso em:


