História da Tabela Periódica
A tabela periódica é um modelo que agrupa todos os elementos químicos conhecidos e apresenta algumas de suas características. Atualmente, a tabela periódica possui 118 elementos químicos.
Evolução da Tabela Periódica
O modelo de tabela periódica que conhecemos atualmente, foi proposto pelo químico russo Dmitri Mendeleiev (1834-1907), no ano de 1869.
A finalidade fundamental de criar uma tabela era para facilitar a classificação, a organização e o agrupamento dos elementos químicos conforme suas propriedades.
Muitos estudiosos já tentavam organizar estas informações e, portanto, muitos modelos anteriores foram apresentados.
Da Grécia Antiga vieram as primeiras tentativas de organizar os elementos conhecidos. Empédocles foi um filósofo grego que falou da existência de quatro "elementos": água, fogo, terra e ar.
Posteriormente, Aristóteles fez a primeira organização desses elementos e lhes associou algumas "propriedades" como úmido, seco, quente e frio.
Antoine Lavoisier (1743-1794) observou que por meio da eletrólise, a água se decompunha em hidrogênio e oxigênio. Classificou então as substâncias encontradas em elementares por não conseguir dividi-las em substâncias mais simples.
Ele identificou alguns dos primeiros elementos químicos e, em 1789, organizou uma lista de 33 elementos divididos em conjuntos de substâncias simples, metálicas, não-metálicas e terrosas, mas não conseguiu estabelecer uma propriedade que os diferenciasse.
Johann W. Döbereiner (1780-1849) foi um dos primeiros a observar uma ordem para organizar os elementos químicos. Como no início do século XIX valores aproximados de massa atômica para alguns elementos haviam sido estabelecidos, ele organizou grupos de três elementos com propriedades semelhantes.

O modelo de classificação proposto por Döbereiner chamou bastante atenção da comunidade científica na época. Ele sugeriu uma organização baseada em tríades, ou seja, os elementos eram agrupados em trios conforme as suas propriedades semelhantes.
A massa atômica do elemento central era a média das massas dos outros dois elementos. Por exemplo, o sódio tinha um valor aproximado de massa que correspondia a média das massas de lítio e potássio. Entretanto, muitos elementos não podiam ser agrupados dessa forma.
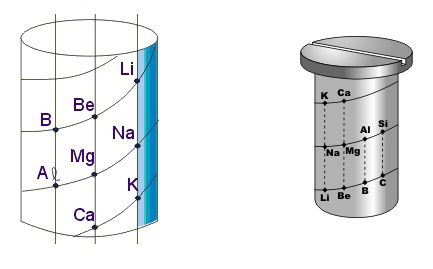
Alexandre-Emile B. de Chancourtois (1820-1886), geólogo francês, organizou 16 elementos químicos por ordem crescente de massa atômica. Para isso, utilizou um modelo conhecido por Parafuso Telúrico.
No modelo proposto por Chancourtois, ocorre a distribuição das informações na base, em forma de cilindro, alinhando verticalmente os elementos com propriedades semelhantes.
John Newlands (1837-1898) também desempenhou papel fundamental. Ele criou a lei das oitavas para os elementos químicos.
Suas observações mostraram que, organizando os elementos por ordem crescente de massa atômica, a cada oito elementos as propriedades se repetiam, estabelecendo assim, uma relação periódica.
O trabalho de Newlands ainda era restrito, pois essa lei se aplicava até o cálcio. Entretanto, seu pensamento foi precursor das ideias de Mendeleiev.
Julius Lothar Meyer (1830-1895), baseando-se principalmente nas propriedades físicas dos elementos, fez uma nova distribuição segundo as massas atômicas.
Ele observou que entre elementos consecutivos, a diferença das massas era constante e concluiu a existência de relação entre massa atômica e propriedades de um grupo.
Através do estudo proposto por Meyer foi possível comprovar a existência de periodicidade, ou seja, ocorrência de propriedades semelhantes em intervalos regulares.
Dmitri Mendeleiev (1834-1907), em 1869, estando na Rússia, teve a mesma ideia que Meyer, que realizava seus estudos na Alemanha. Ele, de forma mais meticulosa, organizou um quadro periódico, onde os 63 elementos químicos conhecidos estavam dispostos em colunas com base em suas massas atômicas.

Além disso, deixou espaços vazios na tabela para os elementos que ainda não eram conhecidos. Mendeleiev era capaz de descrever algumas informações dos elementos faltantes com base na sequência que elaborou.
O Trabalho de Mendeleiev foi o mais completo até então realizado, pois organizou os elementos conforme suas propriedades, reuniu um grande número de informações de maneira simples e constatou que novos elementos seriam descobertos, deixando espaços para inseri-los na tabela.
Até então, nada se sabia a respeito da constituição dos átomos, mas a organização proposta por Meyer-Mendeleiev originou inúmeras investigações para justificar a periodicidade dos elementos e constitui a base da atual Tabela Periódica.
Henry Moseley (1887-1915), em 1913, fez importantes descobertas, estabelecendo o conceito de número atômico. Com o desenvolvimento de estudos para explicar a estrutura dos átomos, um novo passo foi dado para organização dos elementos químicos.
A partir de seus experimentos, ele atribuiu números inteiros a cada elemento e, posteriormente, foi constatada a correspondência ao número de prótons no núcleo do átomo.
Moseley reorganizou a tabela proposta por Mendeleiev de acordo com os números atômicos, eliminando algumas falhas da tabela anterior e estabeleceu o conceito de periodicidade da seguinte forma:
Muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência dos números atômicos.
De fato, todos os modelos propostos, de alguma forma, contribuíram para as descobertas sobre os elementos químicos e suas classificações.
Além disso, foram fundamentais para que chegasse ao modelo atual de tabela periódica que apresenta 118 elementos químicos.
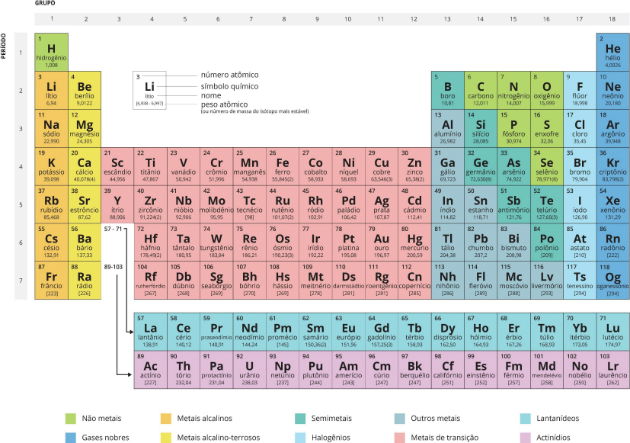
Tabela Periódica Completa e Atualizada
A tabela periódica recebe esse nome em relação à periodicidade, ou seja, os elementos estão organizados de forma que suas propriedades se repetem de forma regular.
Conheça a Tabela Periódica completa e atualizada:
Leia mais sobre assuntos relacionados:
Exercícios sobre a Tabela Periódica
1) Estabeleça a correspondência entre os cientistas, na coluna I, e as contribuições dadas por cada um para a organização dos elementos químicos na Tabela Periódica, na coluna II.
| Coluna I | Coluna II |
|---|---|
| a) Aristóteles | 1) O seu esquema não previa a possibilidade de outros elementos químicos serem descobertos. |
| b) Antoine Lavoisier | 2) Organizou os elementos químicos de acordo com o seu número atômico. |
| c) Johann Döbereiner | 3) Organizou os “elementos”: fogo, água, terra e ar, associando-lhes “propriedades”. |
| d) John Newlands | 4) Identificou alguns dos primeiros elementos químicos. |
| e) Dmitri Mendeleiev | 5) Deixou espaços por preencher na Tabela periódica para elementos que poderiam vir a ser descobertos. |
| f) Henry Moseley | 6) Observou que certos grupos de três elementos partilhavam propriedades semelhantes. |
2) À medida que os elementos químicos foram sendo descobertos, os cientistas foram estudando as suas propriedades e constataram a existência de certas semelhanças nas propriedades de alguns deles. Tal fato levou-os a pensar numa forma de organizar os elementos de acordo com essas propriedades.
Classifique em verdadeiro ou falso as afirmativas a seguir:
2.1 Os elementos químicos conhecidos estão organizados de acordo com suas propriedades na Tabela Periódica.
2.2 A tabela periódica atual contém 118 elementos químicos.
2.3 A tabela periódica atual está organizada por ordem crescente de massa atômica.
Confira questões de vestibulares com resolução comentada em Exercícios sobre a Tabela Periódica e questões inéditas sobre o tema em Exercícios sobre Organização da Tabela Periódica.
Vídeo sobre a Tabela Periódica
BATISTA, Carolina. História da Tabela Periódica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/historia-da-tabela-periodica/. Acesso em:


